题目内容
6. HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2C2O4+H2↑ ①
2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2↑+CO↑②
Na2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO↑ ③
下列说法正确的是( )
| A. | T<415℃,只有反应①发生 | |
| B. | 反应①、②不可能同时发生 | |
| C. | 570℃<T<600℃时,残留固体的主要成分是Na2CO3 | |
| D. | 残留固体中的m(Na2C2O4)=m(Na2CO3)时,反应①、②的反应速率相等 |
分析 加热分解完全残留固体为Na2CO3,失重率为$\frac{30}{136}$×100%≈22.1%,则570℃<T时残留固体的主要成分是Na2CO3,完全分解得到Na2C2O4时,失重率为$\frac{2}{136}$×100%≈1.47%,则T<415℃时反应①、②同时发生,残留固体中的m(Na2C2O4)=m(Na2CO3)时,无法判断所需时间,不能判断反应①、②的反应速率.
解答 解:A.加热完全分解得到Na2C2O4时,失重率为$\frac{2}{136}$×100%≈1.47%<5%,则T<415℃时反应①、②同时发生,故B错误;
B.由A中分析可知,反应①、②可能同时发生,故B错误;
C.加热分解完全残留固体为Na2CO3,失重率为$\frac{30}{136}$×100%≈22.1%,则570℃<T<600℃时,残留固体的主要成分是Na2CO3,故C正确;
D.残留固体中的m(Na2C2O4)=m(Na2CO3)时,无法判断所需时间,不能判断反应①、②的反应速率,故D错误.
故选:C.
点评 本题考查化学图象有关计算,关键是计算特殊点的失重率进行判断,较好地考查学生分析计算与推理能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.A、B、C三种元素的原子核外具有相同的电子层数,其最高价氧化物对应水化物的酸性强弱顺序是 HAO4>H2BO4>H3CO4,则下列判断中错误的是( )
| A. | 原子半径 A>B>C | B. | 气态氢化物的稳定性HA>H2B>H3C | ||
| C. | 阴离子还原性C3->B2->A- | D. | 非金属性A>B>C |
17.高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,工业上用w kg难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),共制备高纯六水氯化锶晶体(a kg)的过程为:
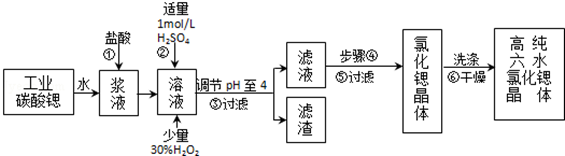
已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
(1)操作①加快反应速率的措施有加热或充分搅拌或适当增加盐酸浓度等(写一种).操作①中盐酸能否改用硫酸,其理由是:不能,否则会大量生成硫酸锶的沉淀,减少产物生成
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为B.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上完成操作③常用的设备有:B
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是B
A.40~50℃B.50~60℃C.60~70℃D.80℃以上.
(7)已知工业流程中锶的利用率为90%,根据以上数据计算工业碳酸锶的纯度:$\frac{1480a}{267W×9}$×100%.

已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为B.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上完成操作③常用的设备有:B
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是B
A.40~50℃B.50~60℃C.60~70℃D.80℃以上.
(7)已知工业流程中锶的利用率为90%,根据以上数据计算工业碳酸锶的纯度:$\frac{1480a}{267W×9}$×100%.
14.已知: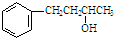 的名称为4-苯基-2-丁醇.下列关于有机物的说法中,正确的是( )
的名称为4-苯基-2-丁醇.下列关于有机物的说法中,正确的是( )
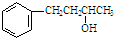 的名称为4-苯基-2-丁醇.下列关于有机物的说法中,正确的是( )
的名称为4-苯基-2-丁醇.下列关于有机物的说法中,正确的是( )| A. |  的名称为3-苯基-2-丙醇 的名称为3-苯基-2-丙醇 | |
| B. | 4-苯基-2-丁醇与 互为同系物 互为同系物 | |
| C. | 4-苯基-2-丁醇分子中的所有碳原子一定共平面 | |
| D. | 4-苯基-2-丁醇的核磁共振氢谱共有8个峰 |
1.下列有关物质结构的说法正确的是( )
| A. | 1molH2O含有2mol氧元素 | |
| B. | 1.8gNH4+中含有的质子数为NA | |
| C. | 3.4g氨气中含有0.6NA个N-H键 | |
| D. | PCl3和HCl分子中所有原子的最外层都达到8电子稳定结构 |
18.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 沸点高的物质制备沸点低的物质 | 钙置换出铷,或浓磷酸制备HI |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | BCl3沸点低于AlCl3,CO2沸点低于SiO2 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴加NaI溶液,会得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |