题目内容
10.有关如图装置中的叙述正确的是( )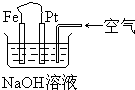
| A. | 这是电解NaOH溶液的装置 | |
| B. | Pt为正极,其电极反应为:O2+2H2O+4eˉ═4OHˉ | |
| C. | Fe为阳极,其电极反应为:Fe-2eˉ+2OHˉ═2Fe(OH)2 | |
| D. | 这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色 |
分析 碱性条件下,铁、铂丝和含有空气的氢氧化钠溶液构成原电池,铁发生吸氧腐蚀,铁作负极,负极上铁失电子发生氧化反应,铂丝作正极,正极上氧气得电子发生还原反应.
解答 解:A.该装置符合原电池的构成条件,所以该装置属于原电池,故A错误;
B.Pt为正极,正极上氧气得电子生成氢氧根离子,其电极反应为:O2+2H2O+4e-═4OH-,故B正确;
C.Fe为负极,其电极反应为:Fe-2eˉ+2OHˉ═2Fe(OH)2,故C错误;
D.该装置符合原电池的构成条件,所以属于原电池,发生铁的吸氧腐蚀,负极上电极反应式为Fe-2e-═Fe2+,正极上的电极反应式为:O2+2H2O+4e-═4OH-,亚铁离子和氢氧根离子反应生成氢氧化亚铁,过量空气会迅速氧化Fe(OH)2生成红褐色的Fe(OH)3,所以不能长时间观察Fe(OH)2沉淀的颜色,故D错误;
故选B.
点评 本题考查了原电池工作原理,题目难度中等,明确原电池原理是解本题关键,根据正负极上得失电子及反应类型来分析解答,难点是电极反应式的书写.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
3.下列有关实验说法中,正确的是( )
| A. | 用浓硝酸做试剂比较铁和铜的金属活动性 | |
| B. | 使用干燥洁净玻璃棒将氯水滴在干燥pH试纸上,测定氯水的pH | |
| C. | 欲检验Br-的存在,可在溶液中先加入氯水、再加入CCl4,振荡、静置,观察下层溶液显橙红色 | |
| D. | 氢氧化铁胶体在直流电场中,一段时间阴极附近红褐色加深,说明胶体带正电荷 |
18.R、M、T、G、J为原子序数依次递增的同一周期主族元素,m、n均为正整数.下列说法一定正确的是( )
| A. | 若T的最低化合价为-3,则J的最高正化合价为+6 | |
| B. | 若HnJOm为强酸,则G是位于ⅤA以后的活泼非金属元素 | |
| C. | 若M(OH)n+1为强碱,则R(OH)n也为强碱 | |
| D. | 若M的最高正化合价为+4,则五种元素都是非金属元素 |
5.在pH=13的无色溶液中,可以大量共存的一组离子是( )
| A. | NH4+、NO3-、K+、SO42- | B. | CO32-、NO3-、HCO3-、Na+ | ||
| C. | Na+、ClO-、AlO2-、NO3- | D. | Cu2+、K+、Na+、SO42- |
15.下列各组物质中,属于同系物的是( )
| A. | HCOOCH3、CH3COOH | B. | 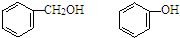 | ||
| C. | C15H31COOH、C17H35COOH | D. | 乙醇、丙三醇 |
19.A、B、C三种元素的原子核外具有相同的电子层数,其最高价氧化物对应水化物的酸性强弱顺序是 HAO4>H2BO4>H3CO4,则下列判断中错误的是( )
| A. | 原子半径 A>B>C | B. | 气态氢化物的稳定性HA>H2B>H3C | ||
| C. | 阴离子还原性C3->B2->A- | D. | 非金属性A>B>C |
17.高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,工业上用w kg难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),共制备高纯六水氯化锶晶体(a kg)的过程为:
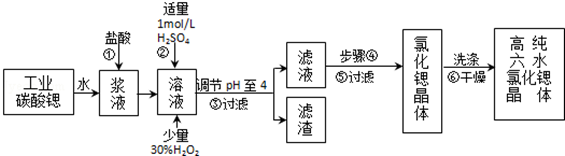
已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
(1)操作①加快反应速率的措施有加热或充分搅拌或适当增加盐酸浓度等(写一种).操作①中盐酸能否改用硫酸,其理由是:不能,否则会大量生成硫酸锶的沉淀,减少产物生成
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为B.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上完成操作③常用的设备有:B
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是B
A.40~50℃B.50~60℃C.60~70℃D.80℃以上.
(7)已知工业流程中锶的利用率为90%,根据以上数据计算工业碳酸锶的纯度:$\frac{1480a}{267W×9}$×100%.

已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为B.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4 (填化学式).
(5)工业上完成操作③常用的设备有:B
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是B
A.40~50℃B.50~60℃C.60~70℃D.80℃以上.
(7)已知工业流程中锶的利用率为90%,根据以上数据计算工业碳酸锶的纯度:$\frac{1480a}{267W×9}$×100%.
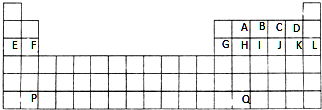
 .
.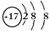 .
.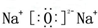 .F的原子结构示意图为
.F的原子结构示意图为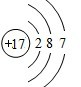 .
.