题目内容
12.锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱.但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+,则下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是②③④.①硫酸铝和氨水 ②偏铝酸钠和稀盐酸 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水.
分析 与量有关的反应,现象不同,可利用相互滴加的实验方法鉴别,以此来解答.
解答 解:①硫酸铝和氨水的反应与量无关,改变滴加顺序均生成白色沉淀,不能鉴别,故不选;
②偏铝酸钠和稀盐酸反应与量有关,盐酸足量不生成沉淀,盐酸少量生成白色沉淀,改变滴加顺序现象不同,能鉴别,故选;
③硫酸锌和氢氧化钠的反应与量有关,NaOH不足生成白色沉淀,NaOH过量沉淀溶解,改变滴加顺序现象不同,能鉴别,故选;
④硫酸锌和氨水的反应与量有关,氨水不足生成白色沉淀,氨水过量沉淀溶解,改变滴加顺序现象不同,能鉴别,故选;
故答案为:②③④.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与实验能力的考查,注意习题信息及元素化合物知识的应用,题目难度不大.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
1.下列对应符号,表述正确的是( )
| A. | 一氯甲烷的结构式CH3C1 | B. | 苯的分子式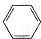 | ||
| C. | 葡萄糖的结构简式C6H12O6 | D. | 丙烷分子的球棍模型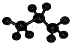 |
3.如表为元素周期表的一部分按要求完成各小题.
(1)化学性质最不活泼的元素Ar(填化学式,下同),非金属性最强的元素是F,金属性最强的单质与水反应的化学方程式为2K+2H2O=2KOH+H2↑
(2)①③⑤三种元素的最高价氧化物的水化物中,碱性最强的是NaOH
(3)元素⑤的最高价氧化物为两性氧化物(填酸性、碱性或两性氧化物),该最高价氧化物与氢氧化钠反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O;向该元素和⑨号元素组成的化合物溶液中,缓缓滴加氢氧化钠溶液至过量,现象为先生成白色沉淀,后沉淀溶解.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ⑥ | ⑦ | ⑧ | |||||
| 3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
| 4 | ② | ④ |
(2)①③⑤三种元素的最高价氧化物的水化物中,碱性最强的是NaOH
(3)元素⑤的最高价氧化物为两性氧化物(填酸性、碱性或两性氧化物),该最高价氧化物与氢氧化钠反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O;向该元素和⑨号元素组成的化合物溶液中,缓缓滴加氢氧化钠溶液至过量,现象为先生成白色沉淀,后沉淀溶解.
20.下列应用和相应原理(用化学方程式表示)及基本反应类型都正确的是( )
| A. | 用纯碱制烧碱 2KOH+Na2CO3=K2CO3+2NaOH 复分解反应 | |
| B. | 我国古代的“湿法炼铜”:2Fe+3CuSO4=3Cu+Fe2(SO4)3置换反应 | |
| C. | 用天然气作燃料 CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O 氧化反应 | |
| D. | 证明金属镁的活动性比铁强:3Mg+2Fe(OH)3=3Mg(OH)2+2Fe 置换反应 |
7.将xmol/LH2SO4溶液aml稀释到bL,稀释后溶液的H+物质的量浓度为( )
| A. | ax/100bmol/L | B. | ax/500bmol/L | C. | ax/2000bmol/L |
17.已知:SO32-+I2+H2O=SO42-+2I-+2H+.某溶液中可能含有Na+、NH4+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等.向该无色溶液中滴加少量溴水,溶液仍呈无色.下列关于该溶液的判断正确的是( )
| A. | 肯定不含I- | B. | 肯定含SO42- | C. | 肯定含有SO32- | D. | 肯定含有NH4+ |
2.浓度为2mol/L的NaOH溶液的正确含义是( )
| A. | 在2L水中溶有80克的NaOH | B. | 80克NaOH溶于2L水配成的溶液 | ||
| C. | 每升溶液中含有80克NaOH | D. | 每2L溶液中含有80克NaOH |