题目内容
6.如图所示,烧杯中都盛有稀硫酸.
(1)A中反应的离子方程式为Fe+2H+=Fe2++H2↑;
(2)B中被腐蚀的金属是Fe、Sn电极反应式为2H++2e-=H2↑.
(3)上述三个装置中,伴随有电流产生的是BC;比较A、B、C中纯铁被腐蚀的速率由快到慢的顺序是B>A>C(用A、B、C排出顺序).
分析 (1)A中铁和稀硫酸发生化学腐蚀,生成硫酸亚铁和氢气;
(2)该装置构成原电池,Fe易失电子作负极、Sn作正极,正极上氢离子得电子发生还原反应而生成氢气;
(3)构成原电池的装置B、C将化学能转化成电能,伴随电流的产生;C装置中Zn易失电子作负极、Fe作正极,作负极的金属加速被腐蚀,作正极的金属被保护,金属腐蚀快慢速率:作负极的金属>发生化学腐蚀的金属>作正极的金属.
解答 解:(1)A中铁和稀硫酸发生化学腐蚀,生成硫酸亚铁和氢气,所以离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(2)该装置构成原电池,Fe易失电子作负极、Sn作正极,负极反应式为Fe-2e-=Fe2+,则铁溶解被腐蚀,正极上氢离子得电子发生还原反应而生成氢气,电极反应式为2H++2e-=H2↑,故答案为:Fe;2H++2e-=H2↑;
(3)构成原电池的装置B、C将化学能转化成电能,伴随电流的产生;C装置中Zn易失电子作负极、Fe作正极,作负极的金属加速被腐蚀,作正极的金属被保护,所以被腐蚀的金属是Zn,其电极反应式为Zn-2e-=Zn2+,金属腐蚀快慢速率:作负极的金属>发生化学腐蚀的金属>作正极的金属,所以铁被腐蚀快慢速率为B>A>C,
故答案为:BC;B>A>C.
点评 本题考查原电池原理,正确判断正负极并会书写电极反应式,知道金属被腐蚀快慢速率,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
14.下列物质加入红墨水中,红墨水褪色的是( )
| A. | 氧化钠 | B. | 溴化钾 | C. | 次氯酸钙 | D. | 碘化钾 |
1.下列对应符号,表述正确的是( )
| A. | 一氯甲烷的结构式CH3C1 | B. | 苯的分子式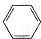 | ||
| C. | 葡萄糖的结构简式C6H12O6 | D. | 丙烷分子的球棍模型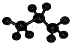 |
16.侯氏制碱法是将CO2通入含NH3的饱和NaCl溶液中,结晶,析出NaHCO3,过滤,将NaHCO3加热分解制得Na2CO3.母液加入NaCl,通入NH3,降温,结晶析出NH4Cl,使母液又成为含NH3的饱和NaCl溶液.下列说法错误的是( )
| A. | 侯氏制碱法的主要原料是NaCl、CO2和NH3 | |
| B. | Na2CO3的热稳定性低于NaHCO3 | |
| C. | 该方法的副产物是NH4Cl | |
| D. | 母液可循环利用 |
17.已知:SO32-+I2+H2O=SO42-+2I-+2H+.某溶液中可能含有Na+、NH4+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等.向该无色溶液中滴加少量溴水,溶液仍呈无色.下列关于该溶液的判断正确的是( )
| A. | 肯定不含I- | B. | 肯定含SO42- | C. | 肯定含有SO32- | D. | 肯定含有NH4+ |
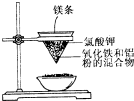 用如图所示的装置进行实验,回答下列问题:
用如图所示的装置进行实验,回答下列问题: