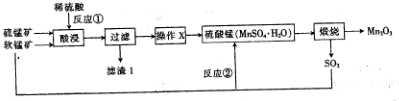
题目内容
11.下列对有机物结构的叙述中不正确的是( )| A. | 硝基、羟基、氯原子、苯环、甲基都是官能团 | |
| B. | 邻二甲苯不存在同分异构体,说明苯分子中所有的碳碳键都是完全相同的 | |
| C. | 乙烯、苯分子中所有原子共平面 | |
| D. | CH2Cl2有两种同分异构体 |
分析 A、根据常见的官能团;
B、根据苯分子中6个碳原子之间的键是完全一样的;
C、根据乙烯、苯的分子构型;
D、根据甲烷是正四面体结构,四个氢原子完全等效.
解答 解:A、硝基、羟基是官能团,而甲基不是官能团,故A错误;
B、若苯分子中存在碳碳单键和碳碳双键交替出现,则邻二氯苯存在同分异构体,实际上邻二氯苯不存在同分异构体也就说明苯分子中6个碳原子之间的键是完全一样的,故B正确;
C、因乙烯是平面形分子,2个碳原子和4个氢原子都在同一平面上,苯是平面形分子,6个碳原子和6个氢原子都在同一平面上,故C正确;
D、根据分子式,可推测CH4的空间结构只有平面正方形和正四面体两种可能.若为平面正方形结构,则其二元取代物有两种同分异构体,而正四面体的二元取代物不存在同分异构体,故D错误;
故选:AD.
点评 本题主要考查了分子的结构,难度不大,掌握分子的结构和证明方法是解题的关键.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
相关题目
19.已知BF3分子的空间构型为平面三角形,用等电子原理判断,下列分子或离子的立体构型不是平面三角形的是( )
| A. | SO3 | B. | PCl3 | C. | NO3- | D. | BCl3 |
6.从下列元素中:H、O、N、Si、S、Mg选出其中的一种或几种,组成典型的四类晶体,要求:每种元素只能出现一次;所填物质必须能够回答问题(2)和(3):
(1)填充下表:
(2)构成晶体B的基态原子的电子排布式为1s22s22p63s23p2,
D中原子采取的堆积方式为A3最密堆积.
(3)将晶体A溶于水,在所得的溶液中加入足量的盐酸,写出该反应的离子方程式2H++S2-=H2S↑.
(1)填充下表:
| 物质代号 | A | B | C | D |
| 晶体类型 | 离子晶体 | 原子晶体 | 分子晶体 | 金属晶体 |
| 相应的化学式 |
D中原子采取的堆积方式为A3最密堆积.
(3)将晶体A溶于水,在所得的溶液中加入足量的盐酸,写出该反应的离子方程式2H++S2-=H2S↑.
3.下列化合物中,既含有离子键,又含有非极性共价键的是( )
| A. | H2O2 | B. | NaOH | C. | Na2O2 | D. | NH4Cl |
1.下列对应符号,表述正确的是( )
| A. | 一氯甲烷的结构式CH3C1 | B. | 苯的分子式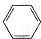 | ||
| C. | 葡萄糖的结构简式C6H12O6 | D. | 丙烷分子的球棍模型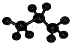 |