题目内容
12.设NA为阿伏加罗常数的值,下列说法正确的是( )| A. | 1molMg在空气中完全燃烧生成MgO和Mg2N3,转移的电子数为NA | |
| B. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| C. | 室温时,1.0LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | Fe与水蒸汽反应生成22.4L氢气,转移电子数为2NA |
分析 A.镁反应生成二价镁离子;
B.CnH2n的链烃含有的C-H键的数目与氢原子数目相同;
C.pH=13的溶液中氢氧根离子浓度为0.1mol/L,1L该溶液中含有0.1mol氢氧根离子;
D.气体状况未知,Vm不确定.
解答 解:A.MgO和Mg3N2的混合物中镁的化合价都为+2价,1mol镁变成镁离子生成2mol电子,共失去2NA个电子,故A错误;
B.14g分子式为CnH2n的链烃中含有氢原子个数为2mol,含有C-H键的数目为2NA,故B正确;
C.常温下,1.0L pH=13的Ba(OH)2溶液中氢氧根离子浓度为0.1mol/L,1L该溶液中含有0.1mol氢氧根离子,含有的OH-数目为0.1NA,故C错误;
D.气体状况未知,Vm不确定,无法计算氢气的物质的量,无法计算转移电子数,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,掌握物质的量与阿伏伽德罗常数、摩尔质量、物质的量浓度等之间的关系是解题关键,注意标准状况下气体摩尔体积的使用条件.

练习册系列答案
相关题目
2. 15ml 0.1mol/L KOH溶液中滴入0.2mol/L(一元弱酸HA),溶液pH和加入弱酸HA体积的关系曲线如图所示,有关离子浓度的大小关系正确的是( )
15ml 0.1mol/L KOH溶液中滴入0.2mol/L(一元弱酸HA),溶液pH和加入弱酸HA体积的关系曲线如图所示,有关离子浓度的大小关系正确的是( )
 15ml 0.1mol/L KOH溶液中滴入0.2mol/L(一元弱酸HA),溶液pH和加入弱酸HA体积的关系曲线如图所示,有关离子浓度的大小关系正确的是( )
15ml 0.1mol/L KOH溶液中滴入0.2mol/L(一元弱酸HA),溶液pH和加入弱酸HA体积的关系曲线如图所示,有关离子浓度的大小关系正确的是( )| A. | 在A、B间任意一点(不包括A、B两点):c(K+)>c(A-)>c(OH-)>c(H+) | |
| B. | 在B点:c(A-)=c(K+)>c(OH-)=c(H+),且a=7.5 | |
| C. | 在C点:c(A-)>c(K+)>c(OH-)>c(H+) | |
| D. | 在D点:c(A -)+c(HA)>2 c(K+) |
20.碳酸亚乙酯是一种重要的添加剂,其结构如图( ),碳酸亚乙酯可由两种分子发生酯化反应制取,这两种分子的原子个数比为( )
),碳酸亚乙酯可由两种分子发生酯化反应制取,这两种分子的原子个数比为( )
 ),碳酸亚乙酯可由两种分子发生酯化反应制取,这两种分子的原子个数比为( )
),碳酸亚乙酯可由两种分子发生酯化反应制取,这两种分子的原子个数比为( )| A. | 3:5 | B. | 1:2 | C. | 2:3 | D. | 2:5 |
7.短周期元素X、Y、Z、W的原子序数依次增大.X原子核内没有中子;Z与W在周期表中同主族,且Y、Z和W三种元素的原子最外层电子数之和为17;X、Y形成的化合物M的水溶液呈碱性.则下列说法不正确的是( )
| A. | 原子半径:W>Y>Z>X | |
| B. | 标准状况下的2.24 LM溶于水,所得溶液pH=13 | |
| C. | YZ2能使湿润的淀粉KI试纸变蓝 | |
| D. | 一定条件下,Cu可与W的最高价氧化物对应水化物发生反应 |
4.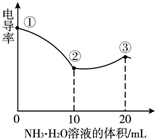 电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol/L的NH3•H2O 滴定10.00mL 浓度均为0.100mol/LHCl和CH3COOH的混合液,电导率曲线如右图所示.下列说法正确的是( )
电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol/L的NH3•H2O 滴定10.00mL 浓度均为0.100mol/LHCl和CH3COOH的混合液,电导率曲线如右图所示.下列说法正确的是( )
 电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol/L的NH3•H2O 滴定10.00mL 浓度均为0.100mol/LHCl和CH3COOH的混合液,电导率曲线如右图所示.下列说法正确的是( )
电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol/L的NH3•H2O 滴定10.00mL 浓度均为0.100mol/LHCl和CH3COOH的混合液,电导率曲线如右图所示.下列说法正确的是( )| A. | ①点溶液中c(H+)为0.200 mol/L | B. | ②点时溶液的温度最低 | ||
| C. | ③点后离子数目减少电导率略降低 | D. | ③点时溶液中有c ( Cl-)>(CH3COO-) |
1.晋葛洪《抱朴子内篇•黄白》记载“曾青涂铁,铁赤色如铜”(“曾青”是指硫酸铜).下列说法不正确的是( )
| A. | 记载中的反应属于置换反应 | B. | 记载中蕴含了湿法炼铜的原理 | ||
| C. | 由记载得出铁单质是赤色(红色) | D. | 每生成1mol铜转移2mol电子 |
2.化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
| A. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| B. | 硅胶可用作食品干燥剂 | |
| C. | “天宫一号”使用的碳纤维,是一种新型有机高分子材料 | |
| D. | 工业上燃烧煤时,加入少量石灰石是为了减少CO2的排放 |

 ,该反应属于消去反应.
,该反应属于消去反应. .
. .
. 和2个-CH3;
和2个-CH3; 的变化).
的变化). .
.


 .
. .
. 等.(任写一种)
等.(任写一种)