题目内容
20.碳酸亚乙酯是一种重要的添加剂,其结构如图( ),碳酸亚乙酯可由两种分子发生酯化反应制取,这两种分子的原子个数比为( )
),碳酸亚乙酯可由两种分子发生酯化反应制取,这两种分子的原子个数比为( )| A. | 3:5 | B. | 1:2 | C. | 2:3 | D. | 2:5 |
分析 酯化反应是醇跟羧酸或含氧无机酸生成酯和水的反应,实质是醇脱羟基上的氢原子,酸脱羟基, 为有机物的结构简式,其中顶点省略的是C原子,每个C原子均形成4对共价键,每个O原子形成2对共价键,C原子价键不饱和的用H原子补充,分子式为:C3H4O3,结合酯化反应的本质分析解答.
为有机物的结构简式,其中顶点省略的是C原子,每个C原子均形成4对共价键,每个O原子形成2对共价键,C原子价键不饱和的用H原子补充,分子式为:C3H4O3,结合酯化反应的本质分析解答.
解答 解:酯化反应实质是醇脱羟基上的氢原子,酸脱羟基, 为有机物的结构简式,其中顶点省略的是C原子,该有机物为乙二醇
为有机物的结构简式,其中顶点省略的是C原子,该有机物为乙二醇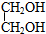 与碳酸(H2CO3)反应而得,这两种分子的原子个数比为10:6,即5:3,只有A符合,
与碳酸(H2CO3)反应而得,这两种分子的原子个数比为10:6,即5:3,只有A符合,
故选A.
点评 本题主要考查的酯化反应的应用,掌握酯化反应实质是醇脱羟基上的氢原子,酸脱羟基为解答关键,题目难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
10.用化学反应原理研究氮的氧化物和硫的氧化物有着重要的意义.
(1)已知:2SO2(g)+O2(g)?2SO3(g)△H1
2NO(g)+O2(g)?2NO2(g)△H2
NO2(g)+SO2(g)?SO3(g)+NO(g)△H3
则△H3=$\frac{△{H}_{1}-△{H}_{2}}{2}$ (用△H1、△H2 表示),如果上述三个反应方程式的平衡常数分别为K1、K2、K3,则K3=$\sqrt{\frac{{K}_{1}}{{K}_{2}}}$(用K1、K2 表示).
(2)如图1所示,A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2,分别将2mol NO 和1mol O2 通过K1、K3 分别充入A、B 中,发生的反应为2NO(g)+O2(g)?2NO2(g)[[不考虑2NO2(g)?N2O4(g)],起始时A、B 的体积相同均为a L.
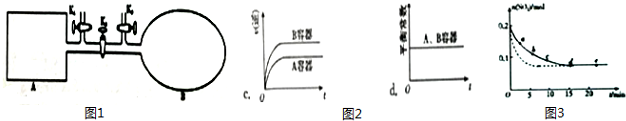
①下列说法和示意图2正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是a.
a.A、B 容器中气体的颜色均不再发生变化
b.A、B 容器中NO 和O2物质的量浓度比均为2:1
②T℃时,A 容器中反应达到平衡时的平衡常数Kp=8×10-2(kPa)-1.若A 容器中反应达到平 衡时p(NO2)=200kPa,则平衡时NO的转化率为66.7%. (Kp 是用平衡分压代替平衡浓=×度计算所得平衡常数,分压 总压 物质的量分数)
(3)将0.2mol SO2 和0.15mol O2通入2L 的密闭容器中,测得SO2的物质的量随时间变化如图3实线所示.
①ab段平均反应速率大于(填“大于”“小于”或“等于”)bc 段平均反应速率:de 段平均反应速率为0.
②仅改变某一个实验条件,测得SO2 的物质的量随时间变化如图3中虚线所示,则改变的条件加入催化剂是加入催化剂.
(1)已知:2SO2(g)+O2(g)?2SO3(g)△H1
2NO(g)+O2(g)?2NO2(g)△H2
NO2(g)+SO2(g)?SO3(g)+NO(g)△H3
则△H3=$\frac{△{H}_{1}-△{H}_{2}}{2}$ (用△H1、△H2 表示),如果上述三个反应方程式的平衡常数分别为K1、K2、K3,则K3=$\sqrt{\frac{{K}_{1}}{{K}_{2}}}$(用K1、K2 表示).
(2)如图1所示,A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2,分别将2mol NO 和1mol O2 通过K1、K3 分别充入A、B 中,发生的反应为2NO(g)+O2(g)?2NO2(g)[[不考虑2NO2(g)?N2O4(g)],起始时A、B 的体积相同均为a L.

①下列说法和示意图2正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是a.
a.A、B 容器中气体的颜色均不再发生变化
b.A、B 容器中NO 和O2物质的量浓度比均为2:1
②T℃时,A 容器中反应达到平衡时的平衡常数Kp=8×10-2(kPa)-1.若A 容器中反应达到平 衡时p(NO2)=200kPa,则平衡时NO的转化率为66.7%. (Kp 是用平衡分压代替平衡浓=×度计算所得平衡常数,分压 总压 物质的量分数)
(3)将0.2mol SO2 和0.15mol O2通入2L 的密闭容器中,测得SO2的物质的量随时间变化如图3实线所示.
| 编号 | a | b | c | d | e |
| n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
| t/min | 2 | 5 | 8 | 15 | 22 |
②仅改变某一个实验条件,测得SO2 的物质的量随时间变化如图3中虚线所示,则改变的条件加入催化剂是加入催化剂.
11.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 28g乙烯中存在的电子总数为12NA | |
| B. | 标准状况下,22.4LHF的物质的量为1mol | |
| C. | 铅蓄电池电解氯化钠溶液,得到标况下22.4L氢气,理论上铅蓄电池中消耗氢离子个数为4NA | |
| D. | lmol的Na2C03溶于盐酸形成混合溶液1L,常温下在pH=4时,c(CO32- )+c(H2C03)=0.lmol/L |
5.下列化学用语表示不正确的是( )
| A. | 钠离子的结构示意图: | |
| B. | 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl | |
| C. | 氢氧根离子的电子式: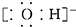 | |
| D. | NaHCO3的电离方程式:NaHCO3=Na++H++CO32- |
12.设NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 1molMg在空气中完全燃烧生成MgO和Mg2N3,转移的电子数为NA | |
| B. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| C. | 室温时,1.0LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | Fe与水蒸汽反应生成22.4L氢气,转移电子数为2NA |
9.能正确表示下列反应的离子方程式为( )
| A. | CaCl2溶液中通入CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 酸性KMnO4溶液中通入SO2:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+ | |
| C. | FeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | AgCl悬浊液中通HI:Ag++HI═AgI↓+H+ |
10.如图所示下列分析错误的是( )


| A. | 只闭合K2,该装置将电能转化为化学能 | |
| B. | 只闭合K1,石墨棒周围溶液pH逐渐升高 | |
| C. | 只闭合K2,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | 铁腐蚀的速度由大到小的顺序是:只闭合K1>都断开>只闭合K2 |
 A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,B的氢化物易溶于C的氢化物中,D的基态原子s轨道与p轨道上的电子数之比为2:3,且D为主族元素;E、F为副族元素,4s能级均只有一个电子.回答下列问题:
A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,B的氢化物易溶于C的氢化物中,D的基态原子s轨道与p轨道上的电子数之比为2:3,且D为主族元素;E、F为副族元素,4s能级均只有一个电子.回答下列问题:
