题目内容
2. 15ml 0.1mol/L KOH溶液中滴入0.2mol/L(一元弱酸HA),溶液pH和加入弱酸HA体积的关系曲线如图所示,有关离子浓度的大小关系正确的是( )
15ml 0.1mol/L KOH溶液中滴入0.2mol/L(一元弱酸HA),溶液pH和加入弱酸HA体积的关系曲线如图所示,有关离子浓度的大小关系正确的是( )| A. | 在A、B间任意一点(不包括A、B两点):c(K+)>c(A-)>c(OH-)>c(H+) | |
| B. | 在B点:c(A-)=c(K+)>c(OH-)=c(H+),且a=7.5 | |
| C. | 在C点:c(A-)>c(K+)>c(OH-)>c(H+) | |
| D. | 在D点:c(A -)+c(HA)>2 c(K+) |
分析 A.开始时c(OH-)>c(HCOO-),所以A、B之间不一定满足c(HCOO-)>c(OH-);
B.当恰好中和时消耗0.2mol/L甲酸溶液7.5mL,溶液显示碱性,欲显中性,甲酸应该稍过量,则有a>7.5;
C.在C点甲酸过量,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒可知c(HCOO-)>c(K+);
D.点甲酸过量,所加入甲酸的物质的量大于KOH的物质的量的2倍,根据物料守恒进行判断.
解答 解:A.在A、B间任意一点,因为开始时c(OH-)>c(HCOO-),即有可能存在:c(K+)>c(OH-)>c(HCOO-)>c(H+),故A错误;
B.当恰好中和时消耗0.2mol/L甲酸溶液7.5mL,反应生成甲酸钠溶液,溶液显示碱性,若溶液为中性,则c(OH-)=c(H+),根据电荷守恒c(K+)=c(HCOO-),由于溶液中存在部分甲酸,则应该满足a>7.5,故B错误;
C.C点甲酸过量,溶液呈酸性,c(H+)>c(OH-),由电荷守恒可得c(HCOO-)>c(K+),所以溶液中离子浓度大小为:c(HCOO-)>c(K+)>c(H+)>c(OH-),故C错误;
D.D点甲酸过量,所加入甲酸的物质的量为:0.02L×0.2mol/L═0.004mol,KOH的物质的量为:0.015L×0.1mol/L=0.0015mol,根据物料守恒,则反应后溶液中一定满足:c(HCOO-)+c(HCOOH)>2c(K+),故D正确;
故选D.
点评 本题考查离子浓度大小比较、酸碱混合溶液PH的判断与计算,题目难度中等,注意从电解质的强弱以及酸碱混合反应的角度分析,注意分析曲线的变化特点,明确电荷守恒、物料守恒的含义为解答关键,试题培养了学生的分析能力及灵活应用能力.

 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案| A. | OH-+2CO32-+3H+→2HCO3-+H2O | B. | 2OH-+CO32-+3H+→HCO3-+2H2O | ||
| C. | 2OH-+CO32-+4H+→CO2↑+3H2O | D. | OH-+CO32-+3H+→CO2↑+2H2O |
(1)已知:2SO2(g)+O2(g)?2SO3(g)△H1
2NO(g)+O2(g)?2NO2(g)△H2
NO2(g)+SO2(g)?SO3(g)+NO(g)△H3
则△H3=$\frac{△{H}_{1}-△{H}_{2}}{2}$ (用△H1、△H2 表示),如果上述三个反应方程式的平衡常数分别为K1、K2、K3,则K3=$\sqrt{\frac{{K}_{1}}{{K}_{2}}}$(用K1、K2 表示).
(2)如图1所示,A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2,分别将2mol NO 和1mol O2 通过K1、K3 分别充入A、B 中,发生的反应为2NO(g)+O2(g)?2NO2(g)[[不考虑2NO2(g)?N2O4(g)],起始时A、B 的体积相同均为a L.
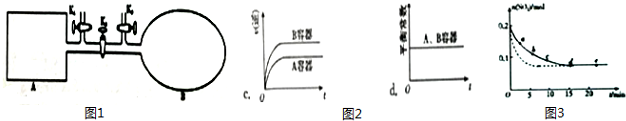
①下列说法和示意图2正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是a.
a.A、B 容器中气体的颜色均不再发生变化
b.A、B 容器中NO 和O2物质的量浓度比均为2:1
②T℃时,A 容器中反应达到平衡时的平衡常数Kp=8×10-2(kPa)-1.若A 容器中反应达到平 衡时p(NO2)=200kPa,则平衡时NO的转化率为66.7%. (Kp 是用平衡分压代替平衡浓=×度计算所得平衡常数,分压 总压 物质的量分数)
(3)将0.2mol SO2 和0.15mol O2通入2L 的密闭容器中,测得SO2的物质的量随时间变化如图3实线所示.
| 编号 | a | b | c | d | e |
| n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
| t/min | 2 | 5 | 8 | 15 | 22 |
②仅改变某一个实验条件,测得SO2 的物质的量随时间变化如图3中虚线所示,则改变的条件加入催化剂是加入催化剂.
| A. | 简单离子半径:乙>丙>丁 | |
| B. | 最高价氧化物对应的水化物的碱性:乙>丙 | |
| C. | 简单气态氢化物稳定性:丁>甲 | |
| D. | 甲和丁组成的化合物在熔融状态下可以导电 |
| A. | CuSO4 | B. | NaNO3 | C. | KCl | D. | H2SO4 |
| A. | 28g乙烯中存在的电子总数为12NA | |
| B. | 标准状况下,22.4LHF的物质的量为1mol | |
| C. | 铅蓄电池电解氯化钠溶液,得到标况下22.4L氢气,理论上铅蓄电池中消耗氢离子个数为4NA | |
| D. | lmol的Na2C03溶于盐酸形成混合溶液1L,常温下在pH=4时,c(CO32- )+c(H2C03)=0.lmol/L |
| A. | 1molMg在空气中完全燃烧生成MgO和Mg2N3,转移的电子数为NA | |
| B. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| C. | 室温时,1.0LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | Fe与水蒸汽反应生成22.4L氢气,转移电子数为2NA |
