题目内容
20.碳及其化合物在生活、化工领域发挥着重要的作用.试回答下列问题: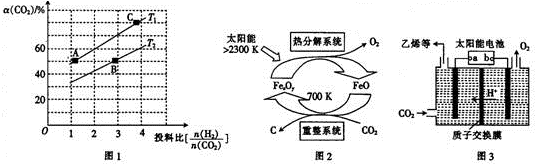
(1)二甲醚(CH30CH3)是无色气体,可作为一种新型能源.工业上可用CO2和H2反应合成
二甲醚:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O (g)△H0已知:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ.mol-1
CH3OCH3(g)+H2O(g)?2CH3OH(g)△H2=+23.4kJ.mol-1
①△H=-130.8kJ.mol-1
②下列能判断恒温恒容条件下合成二甲醚的反应已达到平衡的依据为bc(填字母).
a.气体密度不变
b.压强不变
c.气体平均相对分子质量不变
d.反应前n(C02)=2mol,n(H2)=6mol,一段时间后测得容器中的比值不变
③上述合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图1所示.T1温度下,将6mol CO2和12mol H2充人2L的恒容密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH30CH3)=0.18 mol/(L•min);A、B、C三点对应平衡常数KA、KB.KC之间的大小关系为KA=KC>KB.
(2)有科学家提出由CO2制取C的太阳能工艺如图2所示,若重整系统发生的反应中$\frac{n(FeO)}{n(C{O}_{2})}$=4,则重整系统中发生反应的化学方程式为4FeO+CO2$\frac{\underline{\;700K\;}}{\;}$C+2Fe2O3
(3)以CO2为原料利用电解法可制取乙烯,其装置如图3所示.电极a为电源的负极(填“正极”或“负极”),生成乙烯的电极反应式为2CO2+12e-+12H+=C2H4+4H2O.
(4)常温下,用氨水吸收CO2可得到NH4HCO3溶液.反应NH4++HCO3-+H2O-NH3•H2O+H2CO3的平衡常数K=1.25×10-3.(已知常温下NH3•H2O的电离平衡常数Kb=2×l0-5,H2C03的电离平衡常数K1=4×l0-7)
分析 (1)①依据热化学方程式和盖斯定律计算得到;
②当一个量在反应未平衡的时候一直在变化,而后来不变了,则可以作为平衡的标志,据此分析;
③T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH30为6mol×60%×$\frac{1}{2}$=1.8mol,根据平均反应速率v(CH3OCH3)=$\frac{△c}{△t}$;根据平衡常数仅与温度有关,温度不变,平衡常数不变,在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下较T2温度下正向进行程度大.
(2)根据由CO2制取C的太阳能工艺图示可知,CO2被FeO还原为C,则FeO将被氧化,根据重整系统发生的反应中$\frac{n(FeO)}{n(C{O}_{2})}$=4写出化学方程式;
(3)电极a上通入CO2,生成C2H4,碳元素发生了还原反应,据此分析;根据化合价的变化结合溶液呈酸性来写出电极方程式;
(4)反应NH4++HCO3-+H2O=NH3•H2O+H2CO3的平衡常数K=$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}_{2}C{O}_{3})}{c(N{{H}_{4}}^{+})•c(HC{{O}_{3}}^{-})}$,而NH3•H2O的电离平衡常数表达式Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,H2C03的电离平衡常数K1=$\frac{c(HC{{O}_{3}}^{-})•c({H}^{+})}{c({H}_{2}C{O}_{3})}$,从而可得出平衡常数间的关系,据此分析.
解答 解:(1)①已知反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ.mol-1 I
CH3OCH3(g)+H2O(g)?2CH3OH(g)△H2=+23.4kJ.mol-1 II
将I×2-II可得:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O (g)△H=(-53.7kJ.mol-1)×2-(+23.4kJ.mol-1)=-130.8 kJ.mol-1,故答案为:-130.8 kJ.mol-1;
②对于反应:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O (g)
a.由于是恒容的容器,容器体积V一直不变,而此反应全部是气体参加和生成,故气体的质量一直不变,则气体的密度无论反应有没有达到平衡都一直不变,故不能作为反应达平衡的标志,故a错误;
b.由于容器恒容,而此反应正反应方向是气体的物质的量减小的反应,故反应在平衡之前,容器内的压强在变小,故当压强不变时,说明反应达平衡,故b正确;
c.此反应全部是气体参加和生成,故气体的质量一直不变,而正反应方向是气体的物质的量减小的反应,故平衡之前,气体平均相对分子质量在变大,故当不变时,能说明反应达平衡,故c正确;
d.反应前n(C02)=2mol,n(H2)=6mol,而根据物质的量的该变量等于计量数之比可知,△(C02):△(H2)=2:6,故无论反应是否达到平衡,n(C02):n(H2)恒等于2:6即1:3,故当比值不变时,不能说明反应达平衡,故d错误;
故选bc;
③T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH30为6mol×60%×$\frac{1}{2}$=1.8mol,所以平均反应速率v(CH3OCH3)=$\frac{\frac{1.8mol}{2L}}{5min}$=0.18 mol/(L•min);
平衡常数仅与温度有关,温度不变,平衡常数不变,所以KA=KC,在相同投料比时,T1温度下二氧化碳转化率大,所以T1温度下正向进行程度故T2温度大,则KA=KC>KB,
故答案为:0.18 mol/(L•min);KA=KC>KB.
(2)由CO2制取C的太阳能工艺图示可知,CO2被FeO还原为C,则FeO将被氧化,根据重整系统发生的反应中$\frac{n(FeO)}{n(C{O}_{2})}$=4,结合得失电子数守恒和质量守恒可知反应为:4FeO+CO2$\frac{\underline{\;700K\;}}{\;}$C+2Fe2O3,故答案为:4FeO+CO2$\frac{\underline{\;700K\;}}{\;}$C+2Fe2O3;
(3)电极a上通入CO2,生成C2H4,碳元素发生了还原反应,故电极a为阴极,则所连的是电源的负极;此电极上通入CO2,生成C2H4,碳元素的化合价由+4价变为-2价,结合溶液呈酸性可知极方程式为:2CO2+12e-+12H+=C2H4+4H2O,故答案为:负极;2CO2+12e-+12H+=C2H4+4H2O;
(4)反应NH4++HCO3-+H2O=NH3•H2O+H2CO3的平衡常数K=$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}_{2}C{O}_{3})}{c(N{{H}_{4}}^{+})•c(HC{{O}_{3}}^{-})}$,而NH3•H2O的电离平衡常数表达式Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,H2C03的电离平衡常数K1=$\frac{c(HC{{O}_{3}}^{-})•c({H}^{+})}{c({H}_{2}C{O}_{3})}$,从而可得出平衡常数间的关系K=$\frac{Kw}{{K}_{b}•{K}_{1}}$=$\frac{1{0}^{-14}}{2×1{0}^{-5}×4×1{0}^{-7}}$=1.25×10-3,故答案为:1.25×10-3.
点评 本题考查了盖斯定律的应用、反应达平衡的判断以及平衡常数的有关计算等问题,综合性较强,是高考的常见题型,难度较大.

| A. | 1L0.1mol/L醋酸 | B. | 0.1L 0.1mol/L H2SO4溶液 | ||
| C. | 0.5L 0.1mol/L盐酸 | D. | 2L 0.1mol/L H2SO3溶液 |
| A. | NH4HCO3溶液与过量KOH溶液反应的离子方程式:NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O | |
| B. | 向Ba(OH)2溶液中滴入少量KHSO4溶液的离子方程式:SO42-+H++Ba2++OH-═BaSO4↓+H2O | |
| C. | 明矾水解的离子方程式:Al3++3H2O?Al(OH)3+3H+ | |
| D. | K37ClO3与浓盐酸(HCl)在加热时生成氯气的化学方程式:K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O |
| A. | 含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子 | |
| B. | 500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中反应生成NH3(g),反应达到平衡时放出的热量为7.72kJ,其热化学方程式为:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 对于可逆反应N2(g)+3H2(g)$?_{高温高压}^{催化剂}$2NH3(g)△H<0,升高温度,可使反应速率增大,反应逆向移动 | |
| D. | 元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
| A. | 中子数为18的氯原子可表示为18Cl | |
| B. | 盐酸和食醋既是化合物又是酸 | |
| C. | 可以通过过滤的方法将淀粉胶体中混有的氯化钠溶液除去 | |
| D. | 6.8g熔融KHSO4与3.9g熔融Na2O2中阴离子数目相同 |