题目内容
5.下列物质中:①H2O ②NaHSO4 ③H2SO4 ④Ca(OH)2 ⑤蔗糖(C12H22O11) ⑥FeSO4•7H2O ⑦NaCl溶液 ⑧酒精(C2H5OH) ⑨盐酸 (10)铜.其中属于酸的是③;属于碱的是④;属于盐的是②⑥;属于电解质的是①②③④⑥;属于非电解质的是⑤⑧;属于有机物的是⑤⑧.(填写各物质的序号)
分析 因电离产生的阳离子全部是氢离子的化合物称为酸;电离产生的阴离子全部是氢氧根离子的化合物称为碱;电离生成金属阳离子(或铵根离子)和酸根离子的化合物叫做盐
电解质在熔融状态下或水溶液中能导电的化合物,非电解质是指在水溶液和熔融状态下都不导电的化合物.
解答 解:③H2SO4电离产生的阳离子全部是氢离子的化合物,属于酸;④Ca(OH)2 电离产生的阴离子全部是氢氧根离子的化合物,属于碱;②NaHSO4电离生成金属钠离子和硫酸根离子的化合物,⑥FeSO4•7H2O是电离出亚铁离子和硫酸根离子的化合物,属于盐,①H2O②NaHSO4③H2SO4④Ca(OH)2 ⑥FeSO4•7H2O是在熔融状态下或水溶液中能导电的化合物,属于电解质,⑤蔗糖(C12H22O11)⑧酒精(C2H5OH)是在水溶液和熔融状态下都不导电的化合物,属于非电解质,⑤蔗糖(C12H22O11)⑧酒精(C2H5OH)是含碳元素的有机化合物,故答案为:③;④;②⑥;①②③④⑥;⑤⑧;⑤⑧.
点评 本题主要考查了物质分离方法和物质组成的判断,掌握概念实质和物质组成是解题关键,题目较简单

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
16.上海要建成资源节约和生态保护型省份.下列措施或说法不符合这一理念的是( )
| A. | 推广“绿色自由”计划,吸收空气中的CO2并利用廉价能源合成汽油 | |
| B. | 做好空气质量预报工作,以便污染程度高时进行有效防护 | |
| C. | 工业废水的“再生”处理,用于道路保洁.城市喷泉和洗车等 | |
| D. | 利用风能.生物能发电,强制实施火力发电用煤的脱硫处理 |
13.下列反应中氯元素被氧化的是 ( )
| A. | 5Cl2+I2+6H2O=10HCl+2HIO3 | B. | 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O | ||
| C. | MnO2+4HCl=MnCl2+2H2O+Cl2↑ | D. | 2KClO3=2KCl+3O2 |
10.下列关于氧化还原反应的说法,正确的是( )
| A. | 同一反应中,氧化剂失电子的总数一定等于还原剂得电子的总数 | |
| B. | 氧化剂在反应中被还原,生成氧化产物 | |
| C. | 氧化还原反应的特征是有化合价的升降 | |
| D. | 任何反应中一定有氧化剂和还原剂,且氧化剂和还原剂必须为不同种物质 |
17.下列分子结构中,所有原子都满足最外层为8电子结构的是( )
| A. | 氯化硫(S2Cl2 ) | B. | 次氯酸 | C. | 二氟化氙 | D. | 三氟化硼 |
14.下列反应中,反应后固体物质质量减少的是( )
| A. | 氨气通过灼热的CuO粉末 | B. | 水蒸气通过Na2O2粉末 | ||
| C. | 镁条在CO2中燃烧 | D. | 将铁钉投入Cu(NO3)2溶液 |
15.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 4g D2和足量O2反应可生成D2O的分子数目为2NA | |
| B. | 0.1molCl2与足量NaOH溶液反应,转移电子的数目为0.2NA | |
| C. | 在标准状况下,2.24L氨气所含的电子总数为NA | |
| D. | 标准状况下,6.4 g氧气和臭氧中含有的分子总数为0.2 NA |
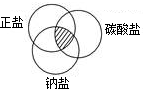 对于数以万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可代替的.现有碳、二氧化碳、氧化铁、澄清石灰水、稀硫酸和碳酸钠溶液等六种物质.通过常见分类法中的交叉分类法,可推出符合右上图阴影的物质的化学式是Na2CO3.
对于数以万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可代替的.现有碳、二氧化碳、氧化铁、澄清石灰水、稀硫酸和碳酸钠溶液等六种物质.通过常见分类法中的交叉分类法,可推出符合右上图阴影的物质的化学式是Na2CO3.