题目内容
12.二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,答下列问題:(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为2:1.
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过图1过程制备ClO2:
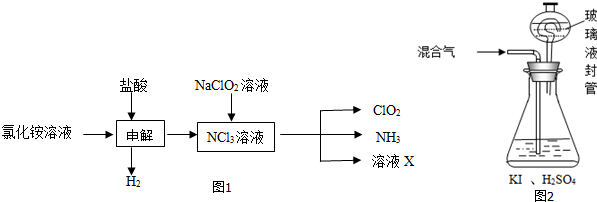
①电解时发生反应的化学方程式为NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$ 3H2↑+NCl3.
②除去ClO2中的NH3可选用的试剂是c(填标号).
a.水b.碱石灰 c.浓硫酸 d.饱和食盐水
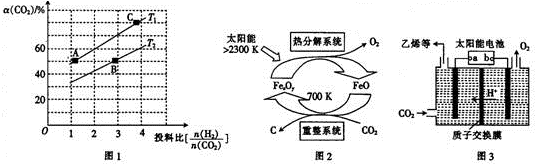
(3)用图2装置可以测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入 3mL 稀硫酸:
Ⅱ.在玻璃液封装置中加入水.使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000mol•L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液.在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
②滴定至终点的现象是溶液由蓝色变为无色,且半分钟内溶液颜色不再改变.
③测得混合气中ClO2的质量为0.02700 g.
分析 (1)KClO3在H2SO4存在下与Na2SO3反应,SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O;
(2)由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑,在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,X中含Cl-、OH-,
①由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑;
②由信息可知,ClO2易溶于水,所以不能利用水溶液吸收,氨气为碱性气体,利用性质差异分离提纯;
(3)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水;
②淀粉遇碘单质变蓝;
③根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2);
解答 解:(1)KClO3在H2SO4存在下与Na2SO3反应制得ClO2,可知SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O,氧化剂为KClO3,还原剂为Na2SO3,由离子反应可知该反应氧化剂与还原剂物质的量之比为2:1,
故答案为:2:1;
(2)①由生产流程可知氯化铵在盐酸溶液中电解,阴极生成氢气,阳极生成NCl3,电解方程式为:NH4Cl+2HClNCl3+3H2↑,
故答案为:NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑;
②除去ClO2中的NH3可选用的试剂是和氨气反应,但不能和ClO2反应,ClO2易溶于水,所以不能利用水溶液吸收,
a.ClO2易溶于水,不能利用水吸收氨,故a错误;
b.碱石灰不能吸收氨气,故b错误;
c.浓硫酸可以吸收氨气,且不影响ClO2,故c正确;
d.ClO2易溶于水,不能利用饱和食盐水吸收氨气,故d错误;
故答案为:c;
(3)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+═2Cl-+5I2+4H2O,
故答案为:2ClO2+10I-+8H+═2Cl-+5I2+4H2O;
②V中加入的指示剂通常为淀粉溶液,碘单质遇到淀粉变蓝色,滴定反应为I2+2S2O32-=2I-+S4O62-,滴定至终点的现象是溶液由蓝色变为无色,且半分钟内不变色,
故答案为:溶液由蓝色变为无色,且半分钟内溶液颜色不再改变;
③用0.1000mol•L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液.含有Na2S2O3物质的量为0.02 L×0.1mol/L=0.002 mol,则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) 0.002mol
所以n(ClO2)=0.0004mol,
所以m(ClO2)=0.004 mol×67.5g/mol=0.02700g,
故答案为:0.02700;
点评 本题考查物质含量的测定,为高频考点,为2015年高考真题,把握物质的性质、制备流程、发生的反应为解答的关键,侧重分析与实验、计算能力的综合考查,综合性较强,题目难度中等.

| A. | AlCl3 | B. | Fe(OH)3 | C. | NaOH | D. | Al(OH)3 |
| A. | Al2O3→NaAlO2 | B. | Fe→FeCl3 | C. | Na2O→Na2CO3 | D. | SiO2→H2SiO3 |
| A. | 氯化硫(S2Cl2 ) | B. | 次氯酸 | C. | 二氟化氙 | D. | 三氟化硼 |
| A. | 碳酸钠溶液和盐酸反应Na2CO3+2H+═2Na++CO2↑+H2O | |
| B. | 过氧化钠和水反应2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| C. | 钠跟水反应Na+H2O═Na++OH-+H2↑ | |
| D. | 碳酸氢钠溶液跟稀硝酸反应HCO3-+H+═CO2↑+H2O |
| A. | 难溶于水的BaCO3是弱电解质 | |
| B. | 0.1mol/L的CH3COOH溶液中H+浓度为0.1mol/L | |
| C. | 强电解质水溶液的导电能力一定比弱电解质的强 | |
| D. | 电解质溶液导电的原因是溶液中有自由移动的阴、阳离子 |
 实验室通常用如右图所示的装置来制取氨气.回答下列问题:
实验室通常用如右图所示的装置来制取氨气.回答下列问题: