题目内容
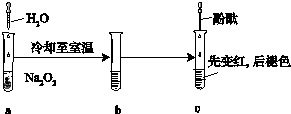 某化学小组进行Na2O2与水反应的实验,如图所示,该小组对试管c中红色褪去的原因进行探究.
某化学小组进行Na2O2与水反应的实验,如图所示,该小组对试管c中红色褪去的原因进行探究.(1)Na2O2中含有的化学键类型:
查阅资料:
①当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色;
②Na2O2与水反应分两步进行:Na2O2+H2O=NaOH+H2O2;2H2O2=2H2O+O2↑
(2)请设计实验验证Na2O2与水反应后的溶液中有H2O2残留:取少量b溶液于试管中,
(3)结合资料,该小组同学针c中溶液红色褪去的原因提出以下假设:
①
②溶液中H2O2破坏酚酞的结构;
③NaOH和H2O2共同作用结果.
(4)该小组同学测出c中溶液的pH为14,认为还不能排除假设②、③,于是又进行了如下实验,请完成下表空白处:
| 实验 | 操作 | 现象 | 结论 |
| 1 | 向少量H2O2中滴加2滴酚酞,放置一段时间,再加入NaOH溶液至pH=12 | 加入NaOH后,无色溶液先变红,后褪色 | ① |
| 2 | 向少量 NaOH溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 | 溶液先变红,后褪色;加盐酸后,又出现红色,且不褪色 | |
| 3 | 向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 … | ② … | 溶液pH大于13时,NaOH使变红的溶液褪色;pH在8~13时,NaOH和H2O2共同作用使溶液褪色 |
考点:性质实验方案的设计,化学实验方案的评价
专题:实验设计题
分析:(1)Na2O2是由钠离子和过氧根离子组成的离子化合物,含有离子键和非极性键;过氧化钠与水反应生成氢氧化钠和氧气;
(2)H2O2在MnO2的催化作用下可分解出氧气,燃气可使带火星的木条复燃;
(3)由题干所给资料①当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色,结合(3)中②③分析;
(4)实验1:加入NaOH溶液至pH=12后,溶液先变红,说明假设②溶液中H2O2破坏酚酞的结构错误,后褪色说明假设③NaOH和H2O2共同作用结果正确;
实验2:向少量 NaOH溶液(pH=14)中滴加2滴酚酞,溶液先变红,后褪色,说明当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色,再加适量稀盐酸至溶液 pH=12,又出现红色,且不褪色,说明PH值小于13时NaOH不能使溶液褪色;
实验3:向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞,溶液pH大于13时,NaOH使变红的溶液褪色,因此现象为溶液先变红,后褪色;再加适量稀盐酸至溶液 pH=12,pH在8~13时,NaOH和H2O2共同作用使溶液褪色,因此现象为加稀盐酸后,又出现红色,但随后褪色;
(5)能导致温度变化的原因是加入稀盐酸,与氢氧化钠发生中和反应而放热,使溶液温度升高.
(2)H2O2在MnO2的催化作用下可分解出氧气,燃气可使带火星的木条复燃;
(3)由题干所给资料①当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色,结合(3)中②③分析;
(4)实验1:加入NaOH溶液至pH=12后,溶液先变红,说明假设②溶液中H2O2破坏酚酞的结构错误,后褪色说明假设③NaOH和H2O2共同作用结果正确;
实验2:向少量 NaOH溶液(pH=14)中滴加2滴酚酞,溶液先变红,后褪色,说明当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色,再加适量稀盐酸至溶液 pH=12,又出现红色,且不褪色,说明PH值小于13时NaOH不能使溶液褪色;
实验3:向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞,溶液pH大于13时,NaOH使变红的溶液褪色,因此现象为溶液先变红,后褪色;再加适量稀盐酸至溶液 pH=12,pH在8~13时,NaOH和H2O2共同作用使溶液褪色,因此现象为加稀盐酸后,又出现红色,但随后褪色;
(5)能导致温度变化的原因是加入稀盐酸,与氢氧化钠发生中和反应而放热,使溶液温度升高.
解答:
解:(1)Na2O2是由钠离子和过氧根离子组成的离子化合物,含有离子键和非极性键;过氧化钠与水反应生成氢氧化钠和氧气,化学方程式为2Na2O2+2H2O=4NaOH+O2↑,
古答案为:离子键、非极性共价键;2Na2O2+2H2O=4NaOH+O2↑;
(2)H2O2在MnO2的催化作用下可分解出氧气,燃气可使带火星的木条复燃,因此可向Na2O2与水反应后的溶液中加入少量MnO2粉末,若产生大量气泡,用带火星的木条检验,木条复燃,则证明溶液中有H2O2残留,
故答案为:加入少量MnO2粉末,产生大量气泡,用带火星的木条检验,木条复燃;
(3)假设②溶液中H2O2破坏酚酞的结构和假设③NaOH和H2O2共同作用结果,由题干所给资料①当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色,因此假设①为溶液中NaOH浓度较大,pH≥13,
古答案为:溶液中NaOH浓度较大,pH≥13;
(4)实验1:加入NaOH溶液至pH=12后,溶液先变红,说明假设②溶液中H2O2破坏酚酞的结构错误,后褪色说明假设③NaOH和H2O2共同作用结果正确;
实验2:向少量 NaOH溶液(pH=14)中滴加2滴酚酞,溶液先变红,后褪色,说明当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色,再加适量稀盐酸至溶液 pH=12,又出现红色,且不褪色,说明PH值小于13时NaOH不能使溶液褪色;
实验3:向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞,溶液pH大于13时,NaOH使变红的溶液褪色,因此现象为溶液先变红,后褪色;再加适量稀盐酸至溶液 pH=12,pH在8~13时,NaOH和H2O2共同作用使溶液褪色,因此现象为加稀盐酸后,又出现红色,但随后褪色;
故答案为:
(5)能导致温度变化的原因是加入稀盐酸,与氢氧化钠发生中和反应而放热,使溶液温度升高,
故答案为:加入稀盐酸,会因发生中和反应而放热,使溶液温度升高.
古答案为:离子键、非极性共价键;2Na2O2+2H2O=4NaOH+O2↑;
(2)H2O2在MnO2的催化作用下可分解出氧气,燃气可使带火星的木条复燃,因此可向Na2O2与水反应后的溶液中加入少量MnO2粉末,若产生大量气泡,用带火星的木条检验,木条复燃,则证明溶液中有H2O2残留,
故答案为:加入少量MnO2粉末,产生大量气泡,用带火星的木条检验,木条复燃;
(3)假设②溶液中H2O2破坏酚酞的结构和假设③NaOH和H2O2共同作用结果,由题干所给资料①当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色,因此假设①为溶液中NaOH浓度较大,pH≥13,
古答案为:溶液中NaOH浓度较大,pH≥13;
(4)实验1:加入NaOH溶液至pH=12后,溶液先变红,说明假设②溶液中H2O2破坏酚酞的结构错误,后褪色说明假设③NaOH和H2O2共同作用结果正确;
实验2:向少量 NaOH溶液(pH=14)中滴加2滴酚酞,溶液先变红,后褪色,说明当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色,再加适量稀盐酸至溶液 pH=12,又出现红色,且不褪色,说明PH值小于13时NaOH不能使溶液褪色;
实验3:向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞,溶液pH大于13时,NaOH使变红的溶液褪色,因此现象为溶液先变红,后褪色;再加适量稀盐酸至溶液 pH=12,pH在8~13时,NaOH和H2O2共同作用使溶液褪色,因此现象为加稀盐酸后,又出现红色,但随后褪色;
故答案为:
| 实验 | 操作 | 现象 | 结论 |
| 1 | 向少量H2O2中滴加2滴酚酞,放置一段时间,再加入NaOH溶液至pH=12 | 加入NaOH后,无色溶液先变红,后褪色 | ①仅H2O2不能破坏酚酞结构,酚酞褪色是H2O2和NaOH共同作用结果 或假设②不正确,假设③正确 |
| 2 | 向少量 NaOH溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 | 溶液先变红,后褪色;加盐酸后,又出现红色,且不褪色 | 溶液pH大于13时,NaOH使变红的溶液褪色;pH在8~13时,NaOH不能使溶液褪色 |
| 3 | 向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 … | ②溶液先变红,后褪色;加稀盐酸后,又出现红色,但随后褪色 … | 溶液pH大于13时,NaOH使变红的溶液褪色;pH在8~13时,NaOH和H2O2共同作用使溶液褪色 |
故答案为:加入稀盐酸,会因发生中和反应而放热,使溶液温度升高.
点评:本题考查了性质实验方案的设计和探究,围绕使酚酞褪色的原因展开实验的设计、然后进行实验验证,具有非常高的思维容量,综合性强,试题难度大,掌握物质的性质、领会题干所给信息是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
为验证甲烷分子中含有碳、氢两种元素,可将其燃烧产物通过①浓H2SO4;②澄清石灰水;③无水硫酸铜.正确的顺序是( )
| A、①②③ | B、②③ |
| C、②③① | D、③② |
有两种饱和一元醇组成的混合物0.92g,该混合物跟足量钠反应生成224mL氢气(标准状况),则两种醇的分子式分别为( )
| A、C2H5OH C3H7OH |
| B、C3H7OH CH3OH |
| C、CH3OH C2H5OH |
| D、C3H7OH C4H9OH |
在一定条件下,CO和CH4燃烧的热化学方程式分别为:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol由CO和CH4组成的混合气体共4mol且CO占25%,该混合气体在上述条件下完全燃烧时,释放的热量为( )
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol由CO和CH4组成的混合气体共4mol且CO占25%,该混合气体在上述条件下完全燃烧时,释放的热量为( )
| A、2912 kJ |
| B、2953 kJ |
| C、3236 kJ |
| D、3867 kJ |
下列各组物质相互反应得到Al(OH)3的是( )
| A、Al跟NaOH溶液共热 |
| B、Al(NO3)3跟过量的NaOH溶液 |
| C、A12O3和水共热 |
| D、A12(SO4)3和过量的NH3?H2O |
向一容积为5L的恒容密闭容器中充入5molA与8molB,在一定条件下如下反应:2A(g)+3B (g)?xC(g)+yD(g)△H<0(式中x、y为正整数).反应进行2min后达到平衡,生成D的物质的量为1.5mol,且这2min内C的平均反应速率v(C)=0.3mol/L?min,又知v(B):v(C)=3:2,则下列说法中不正确的是( )
| A、平均反应速率:v(A)=v(C) |
| B、其它条件不变,升温,气体总的物质的量增加 |
| C、A的平衡浓度为0.4mol/L |
| D、A与B的平衡浓度之比为3:2 |
下列说法,不正确的是( )
| A、Na2O2可用于呼吸面具中氧气的来源 |
| B、Na2O和Na2O2投入水中都能生成NaOH,都是氧化还原反应,它们都是碱性氧化物 |
| C、Na2CO3可用于制玻璃、肥皂、造纸、纺织等工业,而NaHCO3可用于治胃酸过多,制发酵粉等 |
| D、NaCl的性质稳定,可用作调味品 |
 已知2A2(g)+B2(g)?2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ.
已知2A2(g)+B2(g)?2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ.