题目内容
下列各组物质相互反应得到Al(OH)3的是( )
| A、Al跟NaOH溶液共热 |
| B、Al(NO3)3跟过量的NaOH溶液 |
| C、A12O3和水共热 |
| D、A12(SO4)3和过量的NH3?H2O |
考点:镁、铝的重要化合物
专题:几种重要的金属及其化合物
分析:Al(OH)3属于两性氢氧化物,能溶于强酸和强碱,物质相互反应能得到Al(OH)3,可以用可溶性铝盐和弱碱溶液反应制取,也可以用可溶性偏铝酸盐和弱酸反应,据此分析解答.
解答:
解:A.Al和NaOH溶液反应生成NaAlO2,反应方程式为:2NaOH+2Al+2H2O=2NaAlO2+3H2↑,所以得不到Al(OH)3,故A错误;
B.Al(NO3)3与过量的NaOH溶液反应,反应方程式为:Al(NO3)3+4NaOH=NaAlO2+2H2O+3NaNO3,所以得不到Al(OH)3,故B错误;
C.Al2O3与水不反应,所以得不到Al(OH)3,故C错误;
D.A12(SO4)3与过量的氨水反应,反应方程式为:A12(SO4)3+6NH3.H2O=2Al(OH)3↓+3(NH4)2SO4,故D正确;
故选D.
B.Al(NO3)3与过量的NaOH溶液反应,反应方程式为:Al(NO3)3+4NaOH=NaAlO2+2H2O+3NaNO3,所以得不到Al(OH)3,故B错误;
C.Al2O3与水不反应,所以得不到Al(OH)3,故C错误;
D.A12(SO4)3与过量的氨水反应,反应方程式为:A12(SO4)3+6NH3.H2O=2Al(OH)3↓+3(NH4)2SO4,故D正确;
故选D.
点评:本题考查了氢氧化铝的制取,明确氢氧化铝的性质是解本题关键,再结合物质间的反应来分析解答,注意:氢氧化铝只能溶于强碱而不能溶于弱碱,熟练掌握“铝三角”知识网络,灵活运用知识解题,题目难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案
相关题目
在FeCl2和AlCl3的混合溶液中加入过量的Na2O2,直至溶液中沉淀的量不再改变为止. 过滤、洗涤,然后将所得沉淀干燥、灼烧,最终剩余固体的成分是( )
| A、Fe2O3、Al2O3 |
| B、Fe2O3 |
| C、Fe (OH)2、Al (OH)3 |
| D、Fe (OH)3、Al (OH)3 |
 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol/L的NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.则有( )
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol/L的NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.则有( )| A、镁铝合金的质量为0.39 g |
| B、盐酸的物质的量浓度为2mol/L |
| C、B点沉淀的质量 0.39g |
| D、镁铝与盐酸恰好完全反应 |
只用胶头滴管和试管,不用其他试剂就可以区别的下列溶液(浓度均为0.1mol?L-1,)是( )
| A、CaCl2和Na2CO3 |
| B、稀盐酸和K2CO3 |
| C、Ba(OH)2和NaHCO3 |
| D、AgNO3和盐酸 |
25℃时,有体积相同的四种溶液:①pH=3的CH3COOH溶液 ②pH=3的盐酸 ③pH=11的氨水 ④pH=11的NaOH溶液.下列说法不正确的是( )
| A、①与②混合,所得混合溶液的pH=3 |
| B、②和③混合后,溶液呈酸性 |
| C、③和④分别用②中和,消耗②的体积:③>④ |
| D、若将四种溶液稀释100倍,溶液pH大小顺序:③>④>②>① |

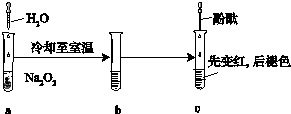 某化学小组进行Na2O2与水反应的实验,如图所示,该小组对试管c中红色褪去的原因进行探究.
某化学小组进行Na2O2与水反应的实验,如图所示,该小组对试管c中红色褪去的原因进行探究.