题目内容
在一定条件下,CO和CH4燃烧的热化学方程式分别为:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol由CO和CH4组成的混合气体共4mol且CO占25%,该混合气体在上述条件下完全燃烧时,释放的热量为( )
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol由CO和CH4组成的混合气体共4mol且CO占25%,该混合气体在上述条件下完全燃烧时,释放的热量为( )
| A、2912 kJ |
| B、2953 kJ |
| C、3236 kJ |
| D、3867 kJ |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:物质放出的热量数值与物质的物质的量成正比,4mol CO和CH4组成的混合气体,CO占25%,为1摩CO和3摩CH4,依据CO、CH4燃烧的热化学方程式分别计算出各自反应放出的热量进行解答.
解答:
解:由CO和CH4组成的混合气体共4mol且CO占25%,则CO的物质的量为4mol×25%=1mol,CH4的物质的量为4mol-1mol=3mol,2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol,1摩CO完全燃烧时释放的热量为283千焦,CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol,1摩CH4完全燃烧时释放的热量为890千焦,所以1摩CO和3摩CH4燃烧后放出的热量为283千焦+890千焦×3=2953千焦,所以该混合气体在上述条件下完全燃烧时,释放的热量为2953千焦,
故选B.
故选B.
点评:本题考查了热化学方程式的计算,题目较简单,注意热化学反应方程式中物质的量与热量的关系.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在FeCl2和AlCl3的混合溶液中加入过量的Na2O2,直至溶液中沉淀的量不再改变为止. 过滤、洗涤,然后将所得沉淀干燥、灼烧,最终剩余固体的成分是( )
| A、Fe2O3、Al2O3 |
| B、Fe2O3 |
| C、Fe (OH)2、Al (OH)3 |
| D、Fe (OH)3、Al (OH)3 |
 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol/L的NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.则有( )
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol/L的NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.则有( )| A、镁铝合金的质量为0.39 g |
| B、盐酸的物质的量浓度为2mol/L |
| C、B点沉淀的质量 0.39g |
| D、镁铝与盐酸恰好完全反应 |

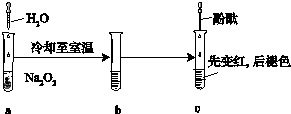 某化学小组进行Na2O2与水反应的实验,如图所示,该小组对试管c中红色褪去的原因进行探究.
某化学小组进行Na2O2与水反应的实验,如图所示,该小组对试管c中红色褪去的原因进行探究.