题目内容
现有0.1mol?L-1的AlCl3溶液和0.1mol?L-1的NaOH溶液,进行下面的实验.
(1)在试管中盛有上述AlCl3溶液10mL,向其中逐渐滴入上述的NaOH溶液.
①加入10mLNaOH溶液时的现象是 ;加入25mL NaOH溶液时的现象是 ;加入35mLNaOH溶液时的现象是 .
②生成沉淀质量最多时,需NaOH溶液 mL.
(2)向盛有30mL NaOH溶液的试管中滴入AlCl3溶液,同时不停摇动试管,出现的现象是 ,至加入 mL AlCl3溶液时开始出现沉淀,至加入 mL AlCl3溶液产生沉淀达最大值.写出上述过程的离子方程式 , .
(1)在试管中盛有上述AlCl3溶液10mL,向其中逐渐滴入上述的NaOH溶液.
①加入10mLNaOH溶液时的现象是
②生成沉淀质量最多时,需NaOH溶液
(2)向盛有30mL NaOH溶液的试管中滴入AlCl3溶液,同时不停摇动试管,出现的现象是
考点:镁、铝的重要化合物,化学方程式的有关计算
专题:几种重要的金属及其化合物
分析:(1)在AlCl3溶液中逐渐加入NaOH溶液,现象是先产生沉淀,后沉淀逐渐消失,反应过程为AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,且前一部分和后一部分消耗的NaOH溶液体积比为3:1,据此来回答;
(2)向盛有30mL NaOH溶液的试管中滴入AlCl3溶液,现象是先无沉淀,后产生白色沉淀,反应过程为Al3++4OH-═AlO2-+2H2O,Al3++3AlO2-+6H2O=4Al(OH)3↓,且前一部分和后一部分消耗的AlCl3溶液体积比为3:1,据此来回答;
(2)向盛有30mL NaOH溶液的试管中滴入AlCl3溶液,现象是先无沉淀,后产生白色沉淀,反应过程为Al3++4OH-═AlO2-+2H2O,Al3++3AlO2-+6H2O=4Al(OH)3↓,且前一部分和后一部分消耗的AlCl3溶液体积比为3:1,据此来回答;
解答:
解:(1)在AlCl3溶液中逐渐加入NaOH溶液,现象是先产生沉淀,后沉淀逐渐消失,反应过程为AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,且前一部分和后一部分消耗的NaOH溶液体积比为3:1,现AlCl3溶液和NaOH溶液同浓度,所以向AlCl3溶液10mL中逐渐滴入上述的NaOH溶液:
①加入10mLNaOH溶液时,只发生AlCl3+3NaOH=Al(OH)3↓+3NaCl,所以现象为产生白色沉淀;加入25mL NaOH溶液时,只发生AlCl3+3NaOH=Al(OH)3↓+3NaCl所以现象为产生白色沉淀;加入35mLNaOH溶液时,反应过程为AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,根据量的关系沉淀只溶解了一半,故现象为先生成白色沉淀,后沉淀又部分溶解;
故答案:生成白色沉淀;生成白色沉淀;先生成白色沉淀,后沉淀又部分溶解;
②根据反应AlCl3+3NaOH=Al(OH)3↓+3NaCl,生成沉淀质量最多时,需NaOH溶液为10mL×3=30mL,故答案为:30;
(2)根据以上分析向盛有30mL NaOH溶液的试管中滴入AlCl3溶液,同时不停摇动试管,出现的现象先无沉淀,后产生白色沉淀;根据Al3++4OH-═AlO2-+2H2O反应当加入 AlCl3溶液为30ml×
=7.5ml时开始出现沉淀,再根据Al3++3AlO2-+6H2O=4Al(OH)3↓,再加入AlCl3溶液为7.5ml×
=2.5ml时沉淀达最大值,所以当加入AlCl3溶液到7.5+2.5=10mL时沉淀最大;
故答案:先无沉淀,后产生白色沉淀;7.5mL;10mL;Al3++4OH-═AlO2-+2H2O;Al3++3AlO2-+6H2O=4Al(OH)3↓.
①加入10mLNaOH溶液时,只发生AlCl3+3NaOH=Al(OH)3↓+3NaCl,所以现象为产生白色沉淀;加入25mL NaOH溶液时,只发生AlCl3+3NaOH=Al(OH)3↓+3NaCl所以现象为产生白色沉淀;加入35mLNaOH溶液时,反应过程为AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,根据量的关系沉淀只溶解了一半,故现象为先生成白色沉淀,后沉淀又部分溶解;
故答案:生成白色沉淀;生成白色沉淀;先生成白色沉淀,后沉淀又部分溶解;
②根据反应AlCl3+3NaOH=Al(OH)3↓+3NaCl,生成沉淀质量最多时,需NaOH溶液为10mL×3=30mL,故答案为:30;
(2)根据以上分析向盛有30mL NaOH溶液的试管中滴入AlCl3溶液,同时不停摇动试管,出现的现象先无沉淀,后产生白色沉淀;根据Al3++4OH-═AlO2-+2H2O反应当加入 AlCl3溶液为30ml×
| 1 |
| 4 |
| 1 |
| 3 |
故答案:先无沉淀,后产生白色沉淀;7.5mL;10mL;Al3++4OH-═AlO2-+2H2O;Al3++3AlO2-+6H2O=4Al(OH)3↓.
点评:本题考查了铝及其化合物性质的分析判断和计算应用,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,明确碱的量的多少对反应的影响及发生的化学反应是解答本题的关键,难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
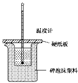 某实验小组学生按照课本实验要求,用50mL0.5mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量计算中和热.下列说法正确的是( )
某实验小组学生按照课本实验要求,用50mL0.5mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量计算中和热.下列说法正确的是( )| A、实验过程中没有热量损失 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎泡沫塑料的作用是固定小烧杯 |
| D、酸或碱的物质的量越大,所测中和热的数值越大 |
下列离子方程式书写正确的是( )
| A、将少量的H2S气体通入硫酸铜溶液中:H2S+Cu2+=CuS↓+2H+ |
| B、将NO2气体通入水中:2NO2+H2O=NO3-+NO↑+2H+ |
| C、ICl 和Cl2的化学性质相似,将ICl通入KOH溶液中:ICl+2OH-=I-+ClO-+H2O |
| D、往100ml 1.5mol/L的FeBr2 溶液中通入0.15mol Cl2:2Br-+Cl2=Br2+2Cl- |
下列有关实验装置进行的相应实验,能达到实验目的是( )
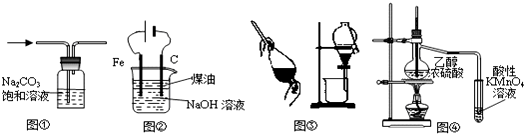

| A、图①除去CO2中的HCl |
| B、图②装置制备Fe(OH)2并能较长时间观察其颜色 |
| C、图③装置可用于分离C2H5OH和H2O的混合物 |
| D、图④证明CH3CH2OH发生消去反应生成了乙烯 |
 )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下: ;
;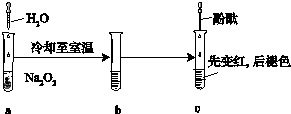 某化学小组进行Na2O2与水反应的实验,如图所示,该小组对试管c中红色褪去的原因进行探究.
某化学小组进行Na2O2与水反应的实验,如图所示,该小组对试管c中红色褪去的原因进行探究.