题目内容
14.由甲醇和乙醇组成的混合液体1.24g,加入足量的钠充分反应后,共产生标准状况下的气体336mL,则原混合物中甲醇和乙醇的物质的量之比为( )| A. | 2:1 | B. | 1:2 | C. | 1:4 | D. | 3:1 |
分析 甲醇和乙醇与钠发生反应:2Na+2R-OH→2R-ONa+H2↑,根据n=$\frac{V}{{V}_{m}}$计算氢气的物质的量,根据方程式计算生成甲醇和乙醇的总物质的量,令甲醇、乙醇的物质的量分别为xmol、ymol,根据二者质量及总物质的量列方程计算解答.
解答 解:标况下,336mL氢气的物质的量=$\frac{336mL×1{0}^{-3}L/mL}{22.4L/mol}$=0.015mol,
乙甲醇和乙醇与钠反应都可以表示为:2Na+2R-OH→2R-ONa+H2↑,由方程式可知,甲醇和乙醇的总物质的量=0.015mol×2=0.03mol,
令甲醇和乙醇的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.03}\\{32x+46y=1.24}\end{array}\right.$
解得:x=0.01,y=0.02,
故甲醇和乙醇的物质的量之比=0.01mol:0.02mol=1:2,
故选B.
点评 本题考查化学方程式的有关计算,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案
相关题目
4.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 42g丙烯和环丙烷的混合气体中所含极性键的数目为9NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的数目为0.5NA | |
| C. | 室温下,1L pH=13的NaOH溶液中,由水电离出的OH-的数目为0.1NA | |
| D. | 3.6 g CaO2晶体中阴离子的数目为0.1NA |
2.我国古代科学术高度发达,在许多成语中都蕴含了化学原理,下列有关解释不正确的是( )
| 成语 | 化学原理 | |
| A | 炉火纯青 | 通过观察火焰的颜色来判断炉内的温度 |
| B | 火树银花 | 发生了焰色反应 |
| C | 百炼成钢 | 通过多次锻炼,使生铁中碳等杂质因挥发而降低达到了钢的标准 |
| D | 青出于蓝而胜于蓝 | 蓝色的靛蓝燃料发生化学反应生成一种深蓝色的新燃料 |
| A. | A | B. | B | C. | C | D. | D |
9.功能高分子是一类以基本合成材料为原料、在其中添加一些特殊的物质或经过特殊的处理后具有特殊功能的高分子材料.下列物质中不属于功能高分子的是( )
| A. | 高分子分离膜 | B. | 隐形眼镜 | C. | 人造丝 | D. | 人造骨酪 |
2.中和滴定是利用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸),若用A代表酸,用B代表碱,可以利用下式来计算未知碱的物质的量浓度的是(ν为化学计量数)( )
| A. | cB=$\frac{ν_B}{ν_A}$•$\frac{{{c_A}{V_A}}}{V_B}$ | B. | cB=$\frac{ν_B}{ν_A}$•$\frac{{{c_A}{V_B}}}{V_A}$ | ||
| C. | cB=$\frac{{{c_A}{V_A}}}{V_B}$ | D. | cB=$\frac{ν_A}{ν_B}$•$\frac{{{c_A}{V_A}}}{V_B}$ |
6.镍电池广泛应用于混合动力汽车系统,电极材料由NiO2、Fe和碳粉涂在铝箔上制成.放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁.由于电池使用后电极材料对环境有危害,某学习小组对该电池电极材料进行回收研究.
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+.
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
回答下列问题:
(1)该电池的正极反应式为NiO2+2H2O+2e-=Ni(OH)2+2OH-;
(2)维持电流强度为1.0A,消耗0.02gFe,理论电池工作1.72min.(写出计算式,已知F=96500C/mol.)
(3)对该电池电极材料进行回收方案设计:
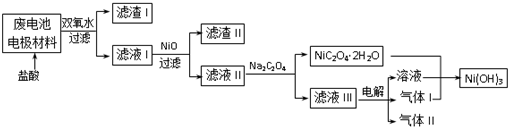
①方案中加入适量双氧水的目的是将溶液中的Fe2+氧化为Fe3+;在滤液I中慢慢加入NiO固体,则依次析出沉淀Fe(OH)3和沉淀Al(OH)3(填化学式).设计将析出的沉淀混合物中的两种物质分离开来的实验方案:将混合物加入氢氧化钠溶液充分溶解、过滤、洗涤得到滤渣为氢氧化铁,将滤液中通入过量二氧化碳气体过滤洗涤得到沉淀氢氧化铝.
②滤液Ⅲ中溶质的主要成分是NaCl(填化学式);气体I为Cl2,判断依据是电解氯化钠溶液,阳极上氯离子失电子生成氯气,Ni(OH)2-Ni(OH)3,镍元素化合价升高需要加入气体为氧化剂所以气体Ⅰ为Cl2.
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+.
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 4.1 | - |
| Fe(OH)3 | 3.5×10-38 | 2.2 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Ni(OH)2 | 6.5×10-18 | 6.4 | 8.4 |
(1)该电池的正极反应式为NiO2+2H2O+2e-=Ni(OH)2+2OH-;
(2)维持电流强度为1.0A,消耗0.02gFe,理论电池工作1.72min.(写出计算式,已知F=96500C/mol.)
(3)对该电池电极材料进行回收方案设计:

①方案中加入适量双氧水的目的是将溶液中的Fe2+氧化为Fe3+;在滤液I中慢慢加入NiO固体,则依次析出沉淀Fe(OH)3和沉淀Al(OH)3(填化学式).设计将析出的沉淀混合物中的两种物质分离开来的实验方案:将混合物加入氢氧化钠溶液充分溶解、过滤、洗涤得到滤渣为氢氧化铁,将滤液中通入过量二氧化碳气体过滤洗涤得到沉淀氢氧化铝.
②滤液Ⅲ中溶质的主要成分是NaCl(填化学式);气体I为Cl2,判断依据是电解氯化钠溶液,阳极上氯离子失电子生成氯气,Ni(OH)2-Ni(OH)3,镍元素化合价升高需要加入气体为氧化剂所以气体Ⅰ为Cl2.
7.下列配制的溶液浓度偏高的是( )
| A. | 配制盐酸溶液用量筒量取盐酸时,俯视刻度线 | |
| B. | NaOH溶解后未经冷却就注入容量瓶并定容至刻度线 | |
| C. | 称量11.7 g NaCl配制0.2 mol•L-1NaCl溶液1 000 mL时,砝码错放在左盘 | |
| D. | 配制盐酸溶液定容时,仰视容量瓶刻度线 |
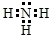 ;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;(填写“极性共价键”、“非极性共价键”、“离子键”)向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O;
;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;(填写“极性共价键”、“非极性共价键”、“离子键”)向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O;