题目内容
16.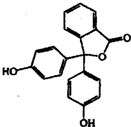 苯酚与邻苯二甲酸酐(
苯酚与邻苯二甲酸酐(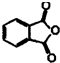 )在一定条件下反应可制得酚酞,酚酞的分子结构如图所示,下列说法正确的是( )
)在一定条件下反应可制得酚酞,酚酞的分子结构如图所示,下列说法正确的是( )| A. | 上述制酚酞的反应属于取代反应 | |
| B. | 酚酞分子中的碳原子有可能共处于同一平面 | |
| C. | 若与NaOH溶液反应.1mol酚酞最多可消耗4 molNaOH | |
| D. | 将酚酞溶于酒精配成的酚酞试剂.滴入中性或酸性水溶液中可能会出现白色浑浊 |
分析 A.有机物中的原子或原子团被其它原子或原子团所取代的反应为取代反应;
B.酚酞中具有甲烷碳原子结构;
C.能和NaOH反应的有酚羟基和酯基水解生成的羧基;
D.酚酞中憎水基对溶解度的影响大于亲水基.
解答 解:A.由结构可知,2分子苯酚与1分子邻苯二甲酸酐反应生成1分子酚酞和1分子水,酚酞中少了1个C=O双键,不是取代反应,故A错误;
B.酚酞中与3个苯环相连的C具有甲烷碳原子结构,所以该反应中所有C原子不可能共平面,故B错误;
C.能和NaOH反应的有酚羟基和酯基水解生成的羧基,所以若与NaOH溶液反应,1mol酚酞最多可消耗3molNaOH,故C错误;
D.酚酞中憎水基对溶解度的影响大于亲水基,所以将酚酞溶于酒精配成的酚酞试剂,滴入中性或酸性水溶液中可能会出现白色浑浊,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意选项A为解答的易错点,注重有机物性质迁移应用能力的训练,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
4.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 42g丙烯和环丙烷的混合气体中所含极性键的数目为9NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的数目为0.5NA | |
| C. | 室温下,1L pH=13的NaOH溶液中,由水电离出的OH-的数目为0.1NA | |
| D. | 3.6 g CaO2晶体中阴离子的数目为0.1NA |
11.海水资源的开发与利用具有广阔的前景,海水的pH一般在7.5~8.6之间.某地海水中主要离子的含量如表:
(1)海水显弱碱性的原因是(用离子方程式表示):HCO3-+H2O?H2CO3+OH-,该海水中Ca2+的物质的量浓度为4×10-3 mol/L.
(2)下面是海水利用电渗析法获得淡水的原理图,电极为惰性电极.请分析下列问题:
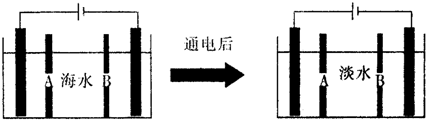
①阳离子交换膜是指B(填A或B).
②写出通电后阳极区的电极反应式:2Cl--2e-=Cl2↑.电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式Ca2++OH-+HCO3-=CaCO3↓+H2O.
(3)水的净化与软化的区别是水的净化是用混凝剂(如明矾等)将水中悬浮物沉淀下来,而水的软化是除去水中的钙离子和镁离子;离子交换法是软化水的常用方法,聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式CH2=CHCOONa.
(4)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收80g Br2时转移的电子为$\frac{5}{6}$mol.
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(2)下面是海水利用电渗析法获得淡水的原理图,电极为惰性电极.请分析下列问题:

①阳离子交换膜是指B(填A或B).
②写出通电后阳极区的电极反应式:2Cl--2e-=Cl2↑.电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式Ca2++OH-+HCO3-=CaCO3↓+H2O.
(3)水的净化与软化的区别是水的净化是用混凝剂(如明矾等)将水中悬浮物沉淀下来,而水的软化是除去水中的钙离子和镁离子;离子交换法是软化水的常用方法,聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式CH2=CHCOONa.
(4)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收80g Br2时转移的电子为$\frac{5}{6}$mol.
1.自1932年由美国物理学家卡尔•安德森在实验中证实了反粒子的存在之后,反物质领域一直成为科学家致力研究的一个重点.“反物质”理论提出:每一种粒子都有一个和它的质量、寿命、自旋严格相等,而电性相反的反粒子.著名的物理学家狄拉克曾大胆地提出了一个假说:存在着一个“反物质”的世界.表为“反物质”的世界中元素周期表的一部分,其中A、X、Y、W、Z为短周期元素,W元素的核电荷数为X元素的2倍.据此,下列说法中错误的是( )
| X | |||
| Y | Z | W | A |
| T | B |
| A. | X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反 | |
| B. | Y、Z、B、W、A元素性质均较为活泼,但其中的某些元素在自然界中仍可以游离态的形式存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阴离子交换膜 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 |
8.氮可形成多种化合物,如NH3、NO2、N2O4等气体.已知NO2和N2O4的结构式分别是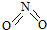 和
和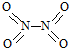 .已知:N-N键能为167kJ•mol-1,NO2中N=O键能为466kJ•mol-1,N2O4中N=O键能为438.5kJ•mol-1.
.已知:N-N键能为167kJ•mol-1,NO2中N=O键能为466kJ•mol-1,N2O4中N=O键能为438.5kJ•mol-1.
(1)写出N2O4转化为NO2的热化学方程式:N2O4(g)=2NO2(g)△H=+57kJ•mol-1.
(2)在100℃时,将0.40mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
①上述条件下,从反应开始直至20s时,NO2的平均反应速率为0.0025mol•L-1•s-1.
②n3=n4(填“>”、“<”或“=”),反应2NO2?N2O4的平衡常数K的数值为2.8(精确到小数点后两位),升高温度后,该反应的平衡常数K将减小(填“增大”、“减小”或“不变”).
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是0.10mol•L-1.
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料.电池的总反应为4NH3(g)+3O2(g)=2N2(g)+6H2O(g),则该燃料电池的负极反应式:2NH3+6OH--6e-=N2+6H2O.
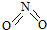 和
和 .已知:N-N键能为167kJ•mol-1,NO2中N=O键能为466kJ•mol-1,N2O4中N=O键能为438.5kJ•mol-1.
.已知:N-N键能为167kJ•mol-1,NO2中N=O键能为466kJ•mol-1,N2O4中N=O键能为438.5kJ•mol-1.(1)写出N2O4转化为NO2的热化学方程式:N2O4(g)=2NO2(g)△H=+57kJ•mol-1.
(2)在100℃时,将0.40mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
②n3=n4(填“>”、“<”或“=”),反应2NO2?N2O4的平衡常数K的数值为2.8(精确到小数点后两位),升高温度后,该反应的平衡常数K将减小(填“增大”、“减小”或“不变”).
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是0.10mol•L-1.
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料.电池的总反应为4NH3(g)+3O2(g)=2N2(g)+6H2O(g),则该燃料电池的负极反应式:2NH3+6OH--6e-=N2+6H2O.
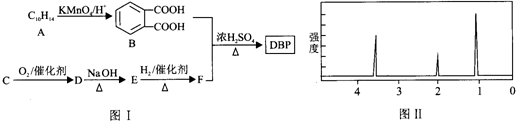
 +H2O(R1、R2示氢原子或烃基)
+H2O(R1、R2示氢原子或烃基) .
.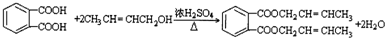 .
.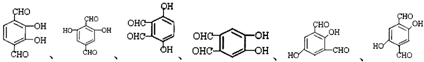 任意2种(填结构简式).
任意2种(填结构简式).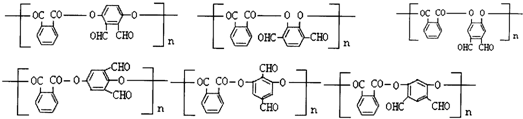 任意一种(填结构简式).
任意一种(填结构简式).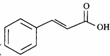 ) 的合成路线
) 的合成路线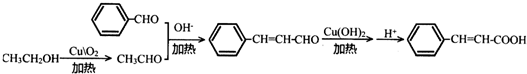 .
. ;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;(填写“极性共价键”、“非极性共价键”、“离子键”)向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O;
;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;(填写“极性共价键”、“非极性共价键”、“离子键”)向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O;