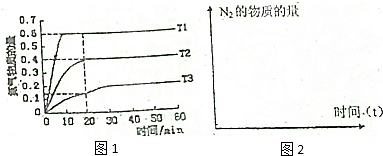
题目内容
18.氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.(1)基态砷原子的核外电子排布式为[Ar]3d104s24p3.氮、磷、砷的第一电离能顺序为N>P>As(填元素符号).
(2)已知N2O为直线形结构,结构式为N=N=O.则N2O是极性(填“极性”或“非极性”)分子.中间的氮原子的杂化轨道类型为sp杂化.
(3)已知下列数据:
| 物质 | 熔点/K | 沸点/K | 分解温度/K |
| NH3 | 195.3 | 239.7 | 1073 |
| PH3 | 139.2 | 185.4 | 713.2 |
(4)根据价层电子对互斥理论,氨分子中的键角<(填“>”、“<”或“=”)109°28′;PO43-离子的空间构型为正四面体.
(5)磷化铝的结构与金刚石相似,其结构单元如图所示:
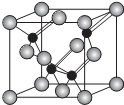
①经过计算,该晶体的化学式是AlP.
②该晶体中是(填“是”或“否”)存在配位键.
分析 (1)As为35号元素,据此书写基态核外电子排布式;同主族第一电离能顺序逐渐减小;
(2)N2O的分子结构不对称,正负电荷的中心不重合,所以是极性分子;N2O与CO2互为等电子体,中间氮原子是中心原子,其杂化类型与C相同,都是sp杂化;
(3)氨分子间形成氢键,所以熔沸点较高;PH3熔化或气化时所需克服的微粒间作用力,与其分解时所需克服的微粒间作用力是不相同的;
(4)孤对电子对σ键的排斥力>σ键和σ键的排斥力,据此解答;计算出PO43-离子的中心原子的价层电子对数判断即可;
(5)①依据均摊法计算晶胞中各种原子的个数,确定化学式
②Al原子存在空轨道,P原子有孤电子对,能形成配位键.
解答 解:(1)As为35号元素,其基态原子的核外电子排布式为:[Ar]3d104s24p3,同主族第一电离能顺序随着原子序数的递增而逐渐减小,故第一电离能:N>P>As,故答案为:[Ar]3d104s24p3;N、P、As;
(2)N2O的结构式为N=N=O,由于它的分子结构不对称,正负电荷的中心不重合,所以是极性分子,N2O为直线形分子,且与CO2互为等电子体,中间氮原子是中心原子,其杂化类型与C相同,都是sp杂化,
故答案为:极性;sp;
(3)由于NH3分子之间存在氢键,所以NH3的沸点高于PH3,PH3分解需要破坏P-H键,PH3气化需要破坏分子间作用力,而化学键比分子间作用力强得多,
故答案为:NH3分子之间存在氢键;PH3分解需要破坏P-H键,PH3气化需要破坏分子间作用力,而化学键比分子间作用力强得多;
(4)氨气分子中存在1对孤电子对,孤对电子对σ键的排斥力>σ键和σ键的排斥力,所以氨分子中的键角小于109°28′,PO43-离子的中心原子的价层电子对数为4+$\frac{1}{2}$(5+3-2×4)=4,没有孤电子对,所以是正四面体结构,
故答案为:<; 正四面体;
(5)①据图所知:每个结构单元中含有4个黑球,8×$\frac{1}{8}$+6×$\frac{1}{2}$=4个白球,故晶胞中磷原子与铝原子的个数比为1:1,所以晶体的化学式为AlP,
故答案为:AlP
②Al原子存在空轨道,P原子有孤电子对,能形成配位键,所以晶体中存在配位键;
故答案为:是.
点评 本题主要考查了基态原子核外电子排布式、晶胞的计算、杂化类型的判断、氢键等知识,综合性较强,难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+.
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 4.1 | - |
| Fe(OH)3 | 3.5×10-38 | 2.2 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Ni(OH)2 | 6.5×10-18 | 6.4 | 8.4 |
(1)该电池的正极反应式为NiO2+2H2O+2e-=Ni(OH)2+2OH-;
(2)维持电流强度为1.0A,消耗0.02gFe,理论电池工作1.72min.(写出计算式,已知F=96500C/mol.)
(3)对该电池电极材料进行回收方案设计:
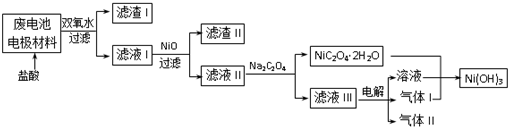
①方案中加入适量双氧水的目的是将溶液中的Fe2+氧化为Fe3+;在滤液I中慢慢加入NiO固体,则依次析出沉淀Fe(OH)3和沉淀Al(OH)3(填化学式).设计将析出的沉淀混合物中的两种物质分离开来的实验方案:将混合物加入氢氧化钠溶液充分溶解、过滤、洗涤得到滤渣为氢氧化铁,将滤液中通入过量二氧化碳气体过滤洗涤得到沉淀氢氧化铝.
②滤液Ⅲ中溶质的主要成分是NaCl(填化学式);气体I为Cl2,判断依据是电解氯化钠溶液,阳极上氯离子失电子生成氯气,Ni(OH)2-Ni(OH)3,镍元素化合价升高需要加入气体为氧化剂所以气体Ⅰ为Cl2.
| A. | 二甲苯 | B. | 丁醇 | C. | 一氯丁烯 | D. | 二氯丙烷 |
| A. | 1 mol Cl2与过量的镁反应,转移 2NA个电子 | |
| B. | 常温常压下,16 g CH4含有 10NA个电子 | |
| C. | 1 mol•L -1 Na2SO4溶液中含有 NA个SO42- | |
| D. | 常温常压下,22.4 L CO2含有N A个CO2分子 |
| 现象或事实 | 主要原因 | |
| A | 燃煤中添加适量CaO可减少SO2排放量 | 燃烧中硫元素转化为CaSO3 |
| B | 聚氯乙烯薄膜不能用于包装食品 | 会造成白色污染 |
| C | 夏天雷雨过后感觉到空气特别的清新 | 空气中O3含量增加、尘埃减少 |
| D | 蒸熟的糯米在适当条件可转化为香甜可口的甜酒 | 部分淀粉水解生成葡萄糖与乙醇 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 配制盐酸溶液用量筒量取盐酸时,俯视刻度线 | |
| B. | NaOH溶解后未经冷却就注入容量瓶并定容至刻度线 | |
| C. | 称量11.7 g NaCl配制0.2 mol•L-1NaCl溶液1 000 mL时,砝码错放在左盘 | |
| D. | 配制盐酸溶液定容时,仰视容量瓶刻度线 |
| 选项 | a | b | 实验现象预期 | 结论 | 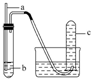 |
| A | 铜丝 | 稀硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 | |
| B | 木条 | 18.4mol•L-1 硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 | |
| C | 生铁 | 醋酸溶液 | c中有大量无色气体 | 生铁发生析氢腐蚀 | |
| D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |
| A. | A | B. | B | C. | C | D. | D |
 ;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;(填写“极性共价键”、“非极性共价键”、“离子键”)向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O;
;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;(填写“极性共价键”、“非极性共价键”、“离子键”)向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O;