题目内容
 (1)利用反应6NO2+8NH3
(1)利用反应6NO2+8NH3| 催化剂 |
| △ |
已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=
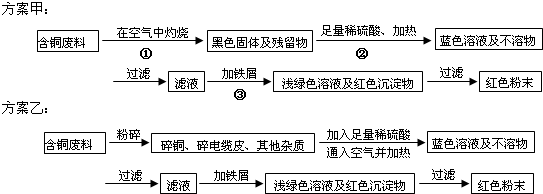
(2)物质A~E都是中学化学中常见的物质,它们可发生如图所表示的反应:
在以上反应中(用序号填空):属于氧化还原反应的是
若以反应⑦设计一个原电池,则原电池的负极材料应为
考点:用盖斯定律进行有关反应热的计算,原电池和电解池的工作原理,化学基本反应类型
专题:
分析:(1)根据化合价的变化结合方程式计算;利用盖斯定律计算反应热;
(2)根据D和氢气生成A,说明D是金属氧化物,或非金属单质,又因为D和稀硫酸能反应,属于D只能是金属氧化物,则A是金属,E和铁反应生成金属A,说明发生置换反应生成金属单质,且又是常见物质,所以A是铜,D是氧化铜,E是硫酸铜,加热C得到氧化铜,所以C是氢氧化铜,B和碱反应生成氢氧化铜,说明B中含有铜离子,结合硫酸铜和氯化钡反应知,B是氯化铜,由此分析解题.
(2)根据D和氢气生成A,说明D是金属氧化物,或非金属单质,又因为D和稀硫酸能反应,属于D只能是金属氧化物,则A是金属,E和铁反应生成金属A,说明发生置换反应生成金属单质,且又是常见物质,所以A是铜,D是氧化铜,E是硫酸铜,加热C得到氧化铜,所以C是氢氧化铜,B和碱反应生成氢氧化铜,说明B中含有铜离子,结合硫酸铜和氯化钡反应知,B是氯化铜,由此分析解题.
解答:
解:(1)反应6NO2+8NH3
7N2+12H2O中,6NO2中N元素化合价降低,由+4价降低到0价,则6molNO2参加反应,转移24mol电子,所以当转移1.2mol电子时,消耗
NO20.3mol,体积为6.72L,已知:①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1,利用盖斯定律将①×
-②×
得NO2(g)+SO2(g)?SO3(g)+NO(g)
△H=
×(-196.6kJ?mol-1)-
×(-113.0kJ?mol-1)=-41.8kJ?mol-1,故答案为:6.72;-41.8;
(2)根据D和氢气生成A,说明D是金属氧化物,或非金属单质,又因为D和稀硫酸能反应,属于D只能是金属氧化物,则A是金属,E和铁反应生成金属A,说明发生置换反应生成金属单质,且又是常见物质,所以A是铜,D是氧化铜,E是硫酸铜,加热C得到氧化铜,所以C是氢氧化铜,B和碱反应生成氢氧化铜,说明B中含有铜离子,结合硫酸铜和氯化钡反应知,B是氯化铜.
反应①是CuO+H2→Cu+H2O,反应中铜元素、氢元素的化合价发生变化,属于氧化还原反应;
反应②是Cu+O2→Cu,反应中铜元素、氧元素的化合价发生变化,属于氧化还原反应;
反应③是CuO+H2SO4→CuSO4+H2O,反应中元素的化合价未发生变化,属于复分解反应;
反应④是CuSO4+BaCl2→BaSO4+CuCl2,属于复分解反应;
反应⑤是CuCl2+碱→Cu(OH)2+新盐,属于复分解反应;
反应⑥是Cu(OH)2→CuO+H2O,属于分解反应;
反应⑦是CuSO4+Fe→Cu+FeSO4,反应中铜元素、铁元素的化合价发生变化,属于氧化还原反应;
属于氧化还原反应的是:①②⑦;属于复分解反应的是:③④⑤;
③的离子方程式为 CuO+2H+=Cu2++H2O;反应CuSO4+Fe=Cu+FeSO4中较活泼的金属铁作负极,所以是铁故答案为:①②⑦;③④⑤; CuO+2H+=Cu2++H2O;
铁.
| 催化剂 |
| 加热 |
NO20.3mol,体积为6.72L,已知:①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1,利用盖斯定律将①×
| 1 |
| 2 |
| 1 |
| 2 |
△H=
| 1 |
| 2 |
| 1 |
| 2 |
(2)根据D和氢气生成A,说明D是金属氧化物,或非金属单质,又因为D和稀硫酸能反应,属于D只能是金属氧化物,则A是金属,E和铁反应生成金属A,说明发生置换反应生成金属单质,且又是常见物质,所以A是铜,D是氧化铜,E是硫酸铜,加热C得到氧化铜,所以C是氢氧化铜,B和碱反应生成氢氧化铜,说明B中含有铜离子,结合硫酸铜和氯化钡反应知,B是氯化铜.
反应①是CuO+H2→Cu+H2O,反应中铜元素、氢元素的化合价发生变化,属于氧化还原反应;
反应②是Cu+O2→Cu,反应中铜元素、氧元素的化合价发生变化,属于氧化还原反应;
反应③是CuO+H2SO4→CuSO4+H2O,反应中元素的化合价未发生变化,属于复分解反应;
反应④是CuSO4+BaCl2→BaSO4+CuCl2,属于复分解反应;
反应⑤是CuCl2+碱→Cu(OH)2+新盐,属于复分解反应;
反应⑥是Cu(OH)2→CuO+H2O,属于分解反应;
反应⑦是CuSO4+Fe→Cu+FeSO4,反应中铜元素、铁元素的化合价发生变化,属于氧化还原反应;
属于氧化还原反应的是:①②⑦;属于复分解反应的是:③④⑤;
③的离子方程式为 CuO+2H+=Cu2++H2O;反应CuSO4+Fe=Cu+FeSO4中较活泼的金属铁作负极,所以是铁故答案为:①②⑦;③④⑤; CuO+2H+=Cu2++H2O;
铁.
点评:本题以无机框图题的形式考查酸、碱、盐、氧化物的相互转化关系、常用化学用语书写、氧化还原、盖斯定律、化学反应类型等,难度中等,根据转化关系判断为酸、碱、盐、氧化物之间的转化,再进行猜测验证,旨在考查学生对基础知识的熟练掌握.

练习册系列答案
相关题目
某单核粒子的最外层电子数为2,有关它的描述正确的是( )
| A、一定在第ⅡA |
| B、可能是金属元素 |
| C、一定是主族元素或0族元素 |
| D、只能有一个电子层 |
下列结构示意图所代表的微粒中,最难发生化学反应的是( )
A、 |
B、 |
C、 |
D、 |
碱金属元素原子最外层的电子的个数都是( )
| A、1e- | B、2e- |
| C、3e- | D、4e- |
去年年末,今年年初我国多省市遭遇雾霾笼罩,雾霾中含有大量的PM2.5,PM2.5首次被纳入标准.PM,英文全称为particulate matter(颗粒物),可吸入颗粒物又称为PM10,PM2.5又称为“细颗粒物”,下列说法不正确的是( )
| A、PM2.5值越大,形成雾霾天气的可能性越大 |
| B、PM2.5容易附着有毒有害物质,尤其是重金属,对人体造成危害 |
| C、城市由于汽车尾气的大量排放,比农村形成雾霾天气的可能性更大 |
| D、氟利昂作制冷剂会加剧雾霾天气的形成 |
往明矾[KAl(SO4)2?12H2O]溶液中滴入Ba(OH)2溶液,当只有一半的硫酸根离子恰好完全沉淀时,铝元素的存在形式为( )
| A、一部分为Al(OH)3,一部分为Al3+ |
| B、全部为Al(OH)3 |
| C、一部分为Al(OH)3,一部分为AlO2- |
| D、全部为AlO2- |
下列叙述中正确的是( )
| A、含a mol AlCl3的溶液和含1.5a mol NaOH的溶液,无论正滴和反滴,生成的Al(OH)3的质量相等 |
| B、含a mol Na2CO3的溶液和含1.5a mol HCl的稀盐酸,无论正滴和反滴,生成的CO2相等 |
| C、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同 |
| D、二份质量相等组成不同的铝钠合金分别投入到足量盐酸中,若放出的H2越多,则铝的质量分数越小 |