题目内容
某单核粒子的最外层电子数为2,有关它的描述正确的是( )
| A、一定在第ⅡA |
| B、可能是金属元素 |
| C、一定是主族元素或0族元素 |
| D、只能有一个电子层 |
考点:原子核外电子排布,原子结构与元素的性质
专题:原子组成与结构专题
分析:某元素原子最外层上只有两个电子,可能为稀有气体He,也可能为第ⅡA族元素,如Mg,还有可能为部分过渡元素,以此来解答.
解答:
解:A.最外层上只有两个电子的元素有零族元素He、ⅡA族元素、部分过渡元素,故A错误;
B.He为非金属元,ⅡA族元素、部分过渡元素,为金属元素,故B正确;
C.可能为部分过渡金属元素,故C错误;
D.He有一个电子层,其他有多个电子层,故D错误,
故选:B.
B.He为非金属元,ⅡA族元素、部分过渡元素,为金属元素,故B正确;
C.可能为部分过渡金属元素,故C错误;
D.He有一个电子层,其他有多个电子层,故D错误,
故选:B.
点评:本题考查原子的结构与元素周期表知识,难度不大,注意把握元素在周期表中的分布、原子结构与位置关系.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
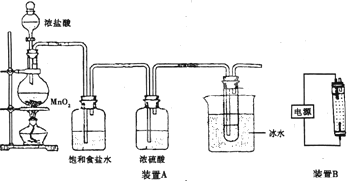
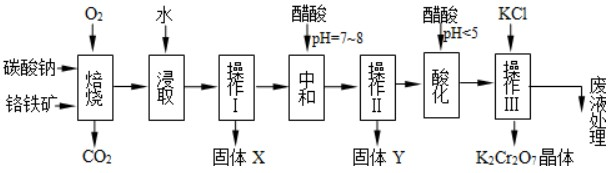
 某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,如图是测定装置的示意图.A中的试剂是盐酸.请回答下列问题:
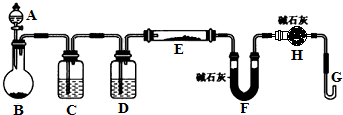
某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,如图是测定装置的示意图.A中的试剂是盐酸.请回答下列问题: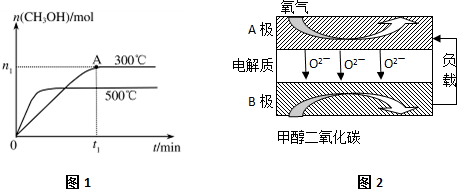
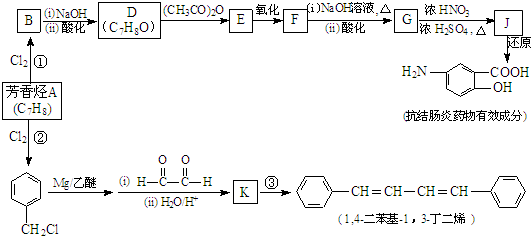
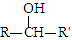 (R、R′表示烃基)
(R、R′表示烃基)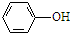
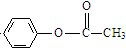
 (1)利用反应6NO2+8NH3
(1)利用反应6NO2+8NH3