题目内容
某化学兴趣小组全体同学进入一家回收含铜电缆废料的工厂做社会调查,工厂负责人向同学们展示两个处理方案,并向同学们提出下列问题:
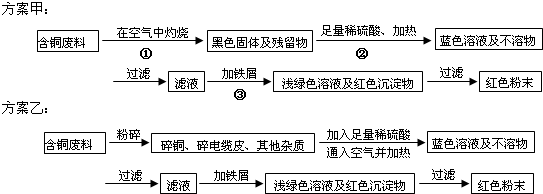
(1)两个方案哪个符合当前生产的绿色理念,为什么? ;
(2)写出方案甲中的②③步骤反应的离子方程式: ;
(3)工厂负责人指出,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑,你认为这么说的道理是: ;
(4)用简便方法检验红色粉末中是否含有过量的铁屑 如果有,请你提出合理的处理方案
(5)为了增加经济效益,该工厂把最后一步所得浅绿色滤液通过 、冷却结晶、 、洗涤、自然干燥得到一种俗称“绿矾”的工业产品.

(1)两个方案哪个符合当前生产的绿色理念,为什么?
(2)写出方案甲中的②③步骤反应的离子方程式:
(3)工厂负责人指出,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑,你认为这么说的道理是:
(4)用简便方法检验红色粉末中是否含有过量的铁屑
(5)为了增加经济效益,该工厂把最后一步所得浅绿色滤液通过
考点:铜金属及其重要化合物的主要性质,金属的回收与环境、资源保护
专题:几种重要的金属及其化合物
分析:(1)绿色理念是指原料利用率高、操作简单、对环境无污染的理念;
(2)氧化铜属于碱性氧化物,能和硫酸反应生成盐和水;铁能将铜从其盐中置换出来;
(3)加入足量的铁,能确保所有的金属铜均被置换出来;
(4)铁可以被磁铁吸引,可以和强酸反应产生氢气;铁能溶于盐酸或硫酸而铜不溶;
(5)硫酸亚铁溶液获得绿矾晶体的操作方法是:蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥.
(2)氧化铜属于碱性氧化物,能和硫酸反应生成盐和水;铁能将铜从其盐中置换出来;
(3)加入足量的铁,能确保所有的金属铜均被置换出来;
(4)铁可以被磁铁吸引,可以和强酸反应产生氢气;铁能溶于盐酸或硫酸而铜不溶;
(5)硫酸亚铁溶液获得绿矾晶体的操作方法是:蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥.
解答:
解:(1)甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾,方案乙中所有的铜原子均转化为硫酸铜,操作简单,符合当前的绿色理念,
故答案为:乙,甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾;
(2)②氧化铜属于碱性氧化物,能和硫酸反应生成盐和水,方程式为CuO+2H+=Cu2++H2O; ③铁排在金属铜的前面,能将铜从其盐中置换出来,方程式为Fe+Cu2+=Fe2++Cu,故答案为:CuO+2H+=Cu2++H2O、Fe+Cu2+=Fe2++Cu;
(3)加入足量的铁,能使所有的金属铜均被置换出来,故答案为:确保Cu完全置换出来;
(4)铁可以被磁铁吸引,也可以和强酸反应产生氢气,可用磁铁检验是否含铁屑(或取样品加入盐酸看有没有气泡产生);铁能溶于盐酸或硫酸而铜不溶,要除去红色粉末铜中所含过量的Fe得干燥的铜,可以将所得铜粉用稀盐酸或稀硫酸清洗后再洗涤、干燥,
故答案为:用磁铁检验是否含铁屑(或取样品加入盐酸看有没有气泡产生);将所得铜粉用稀盐酸或稀硫酸清洗后再洗涤、干燥.
(5)硫酸亚铁溶液获得绿矾晶体的操作方法是:蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥,故答案为:蒸发浓缩、过滤.
故答案为:乙,甲方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾;
(2)②氧化铜属于碱性氧化物,能和硫酸反应生成盐和水,方程式为CuO+2H+=Cu2++H2O; ③铁排在金属铜的前面,能将铜从其盐中置换出来,方程式为Fe+Cu2+=Fe2++Cu,故答案为:CuO+2H+=Cu2++H2O、Fe+Cu2+=Fe2++Cu;
(3)加入足量的铁,能使所有的金属铜均被置换出来,故答案为:确保Cu完全置换出来;
(4)铁可以被磁铁吸引,也可以和强酸反应产生氢气,可用磁铁检验是否含铁屑(或取样品加入盐酸看有没有气泡产生);铁能溶于盐酸或硫酸而铜不溶,要除去红色粉末铜中所含过量的Fe得干燥的铜,可以将所得铜粉用稀盐酸或稀硫酸清洗后再洗涤、干燥,
故答案为:用磁铁检验是否含铁屑(或取样品加入盐酸看有没有气泡产生);将所得铜粉用稀盐酸或稀硫酸清洗后再洗涤、干燥.
(5)硫酸亚铁溶液获得绿矾晶体的操作方法是:蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥,故答案为:蒸发浓缩、过滤.
点评:本题是一道化学实验方案设计和评价的题目,考查学生分析和解决问题的能力,注意平时知识的积累是解题的关键所在,难度较大.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
下列原子中未成对电子数为3的是( )
| A、O | B、N | C、F | D、Cu |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、含有 NA个氦原子的氦气(氦气是单原子分子)在标准状况下的体积约为11.2L |
| B、在标准状况下,11.2L H2O含有的分子数为0.5NA |
| C、在常温常压下,11.2L Cl2含有的分子数为0.5NA |
| D、.25℃,1.01×105Pa,64g SO2中含有的原子数为3NA |
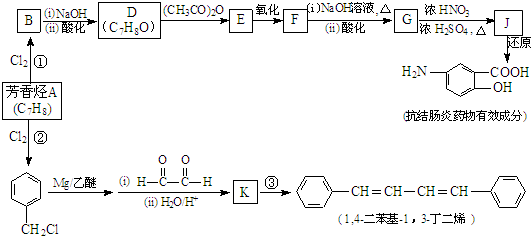
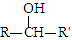 (R、R′表示烃基)
(R、R′表示烃基)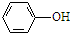
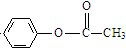
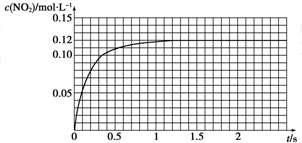
 (1)利用反应6NO2+8NH3
(1)利用反应6NO2+8NH3