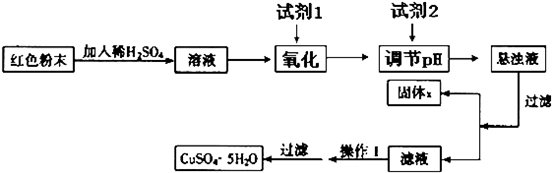
题目内容
往明矾[KAl(SO4)2?12H2O]溶液中滴入Ba(OH)2溶液,当只有一半的硫酸根离子恰好完全沉淀时,铝元素的存在形式为( )
| A、一部分为Al(OH)3,一部分为Al3+ |
| B、全部为Al(OH)3 |
| C、一部分为Al(OH)3,一部分为AlO2- |
| D、全部为AlO2- |
考点:镁、铝的重要化合物
专题:元素及其化合物
分析:向明矾溶液里滴加氢氧化钡溶液,当硫酸根离子沉淀一半时,发生KAl(SO4)2+Ba(OH)2═BaSO4↓+
K2SO4+
Al2(SO4)3+
Al(OH)3↓,以此来解答.
| 1 |
| 2 |
| 1 |
| 6 |
| 2 |
| 3 |
解答:
解:向明矾溶液里滴加氢氧化钡溶液,当硫酸根离子沉淀一半时,
1molKAl(SO4)2需要消耗1molBa(OH)2,
则发生KAl(SO4)2+Ba(OH)2═BaSO4↓+
K2SO4+
Al2(SO4)3+
Al(OH)3↓,
显然铝元素部分以Al(OH)3形式存在于溶液中,部分以Al3+形式存在于溶液中,
故选A.
1molKAl(SO4)2需要消耗1molBa(OH)2,
则发生KAl(SO4)2+Ba(OH)2═BaSO4↓+
| 1 |
| 2 |
| 1 |
| 6 |
| 2 |
| 3 |
显然铝元素部分以Al(OH)3形式存在于溶液中,部分以Al3+形式存在于溶液中,
故选A.
点评:本题主要考查的是离子反应,明确硫酸根离子沉淀一半时消耗的氢氧化钡的量是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
在密闭容器中充入CO2、CO、CH4的混合气体共mg,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增加mg;则CO2与CH4的体积比为( )
| A、3:1 | B、2:l |
| C、1:1 | D、缺少条件,无法计算 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、含有 NA个氦原子的氦气(氦气是单原子分子)在标准状况下的体积约为11.2L |
| B、在标准状况下,11.2L H2O含有的分子数为0.5NA |
| C、在常温常压下,11.2L Cl2含有的分子数为0.5NA |
| D、.25℃,1.01×105Pa,64g SO2中含有的原子数为3NA |
能在水溶液中大量共存的一组离子是( )
| A、NH4+、Ag+、NO3-、I- |
| B、Na+、K+、AlO2-、OH- |
| C、Ca2+、Fe2+、ClO-、Cl- |
| D、Mg2+、Al3+、CO32-、SO42- |
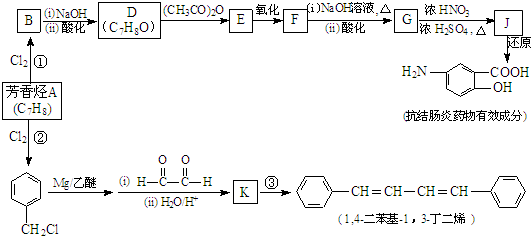
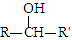 (R、R′表示烃基)
(R、R′表示烃基)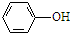
 (1)利用反应6NO2+8NH3
(1)利用反应6NO2+8NH3