��Ŀ����
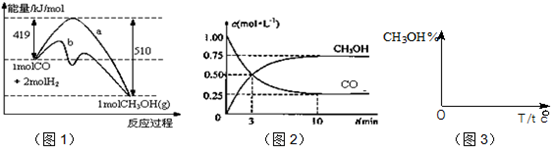
��ҵ����CO����ȼ�ϼ״���һ�������·�����Ӧ��CO��g��+2H2��g��?CH3OH��g����ͼ1��ʾ��Ӧ�������ı仯��ͼ2��ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H2��һ������CO��CO��CH3OH��g����Ũ����ʱ��仯��
��ش��������⣺
��1���ڡ�ͼ1���У����� ���a��b����ʾʹ���˴������÷�Ӧ���� ��Ӧ��
��2������˵����ȷ���� ��
A����ʼ�����COΪ2mol B������COŨ�ȣ�CO��ת��������
C��������ѹǿ�㶨ʱ����Ӧ�Ѵ�ƽ��״̬ D�������¶Ⱥ��ܱ������ݻ����䣬�ٳ���1molCO��2molH2���ٴδﵽƽ��ʱ��n��CH3OH��/n��CO�����С
��3���ӷ�Ӧ��ʼ������ƽ�⣬v��H2��= �����¶���CO��g��+2H2��g��?CH3OH��g���Ļ�ѧƽ�ⳣ��ֵΪ �������������������䣬����Ӧ��ϵ���£���÷�Ӧ��ѧƽ�ⳣ�� �����������С�����䡱����
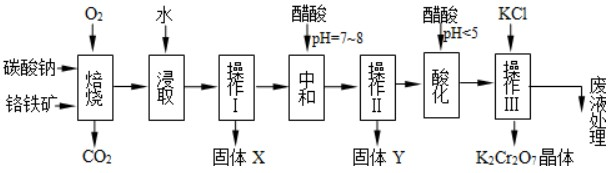
��4�����ڡ�ͼ3���л���ƽ��ʱ�״��ٷֺ����������꣩���¶ȣ������꣩�仯�����ߣ�Ҫ��ѹǿ��ͬ��2�����ߣ��������ϱ��P1��P2����P1��P2����
��5����һ��״����ӽ���Ĥȼ�ϵ�أ��轫�״�����ת��Ϊ���������ַ�Ӧԭ����
A��CH3OH��g��+H2O��g��=CO2��g��+3H2��g������H=+49.0kJ/mol
B��CH3OH��g��+
O2��g��=CO2��g��+2H2O��g������H=-192.9kJ/mol
��֪H2O��l��=H2O��g����H=+44kJ/mol����д��32g��CH3OH��g����ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ ��

��ش��������⣺
��1���ڡ�ͼ1���У�����
��2������˵����ȷ����
A����ʼ�����COΪ2mol B������COŨ�ȣ�CO��ת��������
C��������ѹǿ�㶨ʱ����Ӧ�Ѵ�ƽ��״̬ D�������¶Ⱥ��ܱ������ݻ����䣬�ٳ���1molCO��2molH2���ٴδﵽƽ��ʱ��n��CH3OH��/n��CO�����С
��3���ӷ�Ӧ��ʼ������ƽ�⣬v��H2��=
��4�����ڡ�ͼ3���л���ƽ��ʱ�״��ٷֺ����������꣩���¶ȣ������꣩�仯�����ߣ�Ҫ��ѹǿ��ͬ��2�����ߣ��������ϱ��P1��P2����P1��P2����
��5����һ��״����ӽ���Ĥȼ�ϵ�أ��轫�״�����ת��Ϊ���������ַ�Ӧԭ����
A��CH3OH��g��+H2O��g��=CO2��g��+3H2��g������H=+49.0kJ/mol
B��CH3OH��g��+
| 3 |
| 2 |
��֪H2O��l��=H2O��g����H=+44kJ/mol����д��32g��CH3OH��g����ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ
���㣺��ѧƽ�⽨���Ĺ���,�ø�˹���ɽ����йط�Ӧ�ȵļ���
ר�⣺
��������1������ͼ�з�Ӧ�Ļ�ܵĴ�С�������Ƿ�ʹ�ô��������÷�Ӧǰ�����������������Ӧ�������仯��
��2��a������ת����CO��ƽ��ʱCO������������
b������COŨ�ȣ���ٽ�������ת����
c���÷�ӦΪ��Ӧǰ��ѹǿ���ȵķ�Ӧ��
d���ٳ���1molCO��2molH2��������䣬��ѹǿ����ƽ�������ƶ���
��3����ͼ2������CO��ʾ�ķ�Ӧ���ʣ������÷�Ӧ����֮�ȵ��ڻ�ѧ������֮�������������ķ�Ӧ���ʣ�����ƽ�ⳣ������ʽ���м��㣻����Ӧ�Ƿ��ȷ�Ӧ�¶�Խ��KֵԽС��
��4�������¶Ⱥ�ѹǿ�Ը÷�Ӧ��Ӱ����������
��5�����ݸ�˹���ɼ��㣮
��2��a������ת����CO��ƽ��ʱCO������������
b������COŨ�ȣ���ٽ�������ת����
c���÷�ӦΪ��Ӧǰ��ѹǿ���ȵķ�Ӧ��
d���ٳ���1molCO��2molH2��������䣬��ѹǿ����ƽ�������ƶ���
��3����ͼ2������CO��ʾ�ķ�Ӧ���ʣ������÷�Ӧ����֮�ȵ��ڻ�ѧ������֮�������������ķ�Ӧ���ʣ�����ƽ�ⳣ������ʽ���м��㣻����Ӧ�Ƿ��ȷ�Ӧ�¶�Խ��KֵԽС��
��4�������¶Ⱥ�ѹǿ�Ը÷�Ӧ��Ӱ����������
��5�����ݸ�˹���ɼ��㣮
���
�⣺��1����ͼ��֪������b�����˷�Ӧ����Ļ�ܣ���bʹ���˴������ָ÷�Ӧ�з�Ӧ������������������������������÷�ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ��b�����ȣ�
��2��A����ͼ2��֪����0.75mol/LCH3OH����Ӧ��0.75mol/LCO��ƽ��ʱ��0.25mol/LCO����CO����ʼ���ʵ���Ϊ��0.75mol/l+0.25mol/L����2L=2mol����A��ȷ��
B������COŨ�ȣ���ٽ�������ת����������ת��������CO��ת���ʼ�С����B����
C���÷�ӦΪ��Ӧǰ��ѹǿ���ȵķ�Ӧ����ѹǿ����ʱ���÷�Ӧ�ﵽƽ��״̬����C��ȷ��
D���ٳ���1molCO��2molH2��������䣬��ѹǿ����ƽ�������ƶ����ٴδﵽƽ��ʱn��CH3OH��/n��CO��������D����
�ʴ�Ϊ��AC��
��3����ͼ2��֪����Ӧ�м�С��CO��Ũ��Ϊ1mol/L-0.25mol/L=0.75mol/L��10minʱ�ﵽƽ�⣬
����CO��ʾ�Ļ�ѧ��Ӧ����Ϊ
=0.075mol?L-1?min-1��
��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ���v��H2��=0.075mol?L-1?min-1��2=0.15mol?L-1?min-1��
CO��g��+2H2��g��?CH3OH��g��
��ʼ��1mol/L 2mol/L 0
ת����0.75mol/L 1.5mol/L 0.75mol/L
ƽ�⣺0.25mol/L 0.5mol/L 0.75mol/L
��ѧƽ�ⳣ��K=
=
&;)2=12 L2?mol-2��
����Ӧ�Ƿ��ȷ�Ӧ�¶�Խ��KֵԽС��
�ʴ�Ϊ��0.15mol?L-1?min-1��12 L2?mol-2����С��
��4��CO��g��+2H2��g��?CH3OH��g����H��0�����¶�Խ�ߣ�����Ӧ���еij̶�Խ�״��ĺ�����Խ�ͣ�ѹǿ����Ӧ������еij̶ȴ���״��ĺ����ߣ��״��ٷֺ������¶�T�仯��ͼΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��5��32g��CH3OH��g����Ϊ1mol��
��CH3OH��g��+
O2��g��=CO2��g��+2H2O��g����H=-192.9kJ/mol ��
H2O��l��=H2O��g����H=+44kJ/mol ��
���ݸ�˹���ɢ�-�ڡ�2�� CH3OH��g��+
O2��g��=CO2��g��+2H2O��l����H=-280.9kJ/mol
�ʴ�Ϊ��CH3OH��g��+
O2��g��=CO2��g��+2H2O��l����H=-280.9kJ/mol��
�ʴ�Ϊ��b�����ȣ�
��2��A����ͼ2��֪����0.75mol/LCH3OH����Ӧ��0.75mol/LCO��ƽ��ʱ��0.25mol/LCO����CO����ʼ���ʵ���Ϊ��0.75mol/l+0.25mol/L����2L=2mol����A��ȷ��
B������COŨ�ȣ���ٽ�������ת����������ת��������CO��ת���ʼ�С����B����
C���÷�ӦΪ��Ӧǰ��ѹǿ���ȵķ�Ӧ����ѹǿ����ʱ���÷�Ӧ�ﵽƽ��״̬����C��ȷ��
D���ٳ���1molCO��2molH2��������䣬��ѹǿ����ƽ�������ƶ����ٴδﵽƽ��ʱn��CH3OH��/n��CO��������D����
�ʴ�Ϊ��AC��
��3����ͼ2��֪����Ӧ�м�С��CO��Ũ��Ϊ1mol/L-0.25mol/L=0.75mol/L��10minʱ�ﵽƽ�⣬
����CO��ʾ�Ļ�ѧ��Ӧ����Ϊ
| 0.75mol/L |
| 10min |
��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ���v��H2��=0.075mol?L-1?min-1��2=0.15mol?L-1?min-1��
CO��g��+2H2��g��?CH3OH��g��
��ʼ��1mol/L 2mol/L 0
ת����0.75mol/L 1.5mol/L 0.75mol/L
ƽ�⣺0.25mol/L 0.5mol/L 0.75mol/L
��ѧƽ�ⳣ��K=
| c(CH3OH) |
| c(CO)?c2(H2) |
| 0.75mol/L |
| 0.25mol/L��(0.5mol/L |
����Ӧ�Ƿ��ȷ�Ӧ�¶�Խ��KֵԽС��
�ʴ�Ϊ��0.15mol?L-1?min-1��12 L2?mol-2����С��
��4��CO��g��+2H2��g��?CH3OH��g����H��0�����¶�Խ�ߣ�����Ӧ���еij̶�Խ�״��ĺ�����Խ�ͣ�ѹǿ����Ӧ������еij̶ȴ���״��ĺ����ߣ��״��ٷֺ������¶�T�仯��ͼΪ
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
����5��32g��CH3OH��g����Ϊ1mol��
��CH3OH��g��+
| 3 |
| 2 |
H2O��l��=H2O��g����H=+44kJ/mol ��
���ݸ�˹���ɢ�-�ڡ�2�� CH3OH��g��+
| 3 |
| 2 |
�ʴ�Ϊ��CH3OH��g��+
| 3 |
| 2 |
���������⿼���˻�ѧƽ���ƶ�ԭ������˹���ɵ�֪ʶ�㣬��ȷ�⼸��ԭ�������ǽⱾ��ؼ����ѵ��ǻ�ѧƽ���ƶ����йؼ��㡢�жϣ�����Щ���Ǹ߿��ȵ㣬Ӧ�������գ��Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
����ԭ����δ�ɶԵ�����Ϊ3���ǣ�������
| A��O | B��N | C��F | D��Cu |
����ˮ��Һ�д��������һ�������ǣ�������
| A��NH4+��Ag+��NO3-��I- |
| B��Na+��K+��AlO2-��OH- |
| C��Ca2+��Fe2+��ClO-��Cl- |
| D��Mg2+��Al3+��CO32-��SO42- |
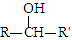 ��R��R���ʾ������
��R��R���ʾ������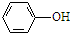
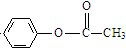
 ��1�����÷�Ӧ6NO2+8NH3
��1�����÷�Ӧ6NO2+8NH3