题目内容
5.实验室制备硝基苯,主要步骤如下:①配制一定比例的浓硫酸与浓硝酸形成的混合酸,加入反应器中.
②向室温下的混合酸中逐滴加入一定质量的苯,充分振荡,混合均匀.
③在50~60℃下发生反应,直至反应结束.
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤.
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯.
填写下列空白:
(1)步骤①中,配制一定比例的浓硫酸与浓硝酸形成的混合酸时,应先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却.
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是反应器放在50~60℃的水浴加热.
(3)步骤④中洗涤和分离粗硝基苯应使用的仪器是分液漏斗.
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是除H2SO4、HNO3、NO2等物质.
分析 (1)结合浓硫酸的特殊性质,溶解于水时能放出大量的热,混合时先加密度小的,后加密度大的,并不断搅拌,防止热量来不及散失导致液滴飞溅;
(2)水浴加热可保证温度在50~60℃下;
(3)洗涤和分离粗硝基苯,因硝基苯不溶于水,与混酸分层;
(4)H2SO 4、HNO3、NO2等与NaOH反应后,与硝基苯分层.
解答 解:(1)配制一定比例浓硫酸与浓硝酸形成的混合酸时,操作注意事项是先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却,
故答案为:浓硝酸;浓硫酸;
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是反应器放在50~60℃的水浴加热,
故答案为:反应器放在50~60℃的水浴加热;
(3)因硝基苯不溶于水,与混酸分层,则步骤④中洗涤和分离粗硝基苯应使用的仪器是分液漏斗,
故答案为:分液漏斗;
(4)H2SO 4、HNO3、NO2等与NaOH反应后,与硝基苯分层,然后分液可分离,则步骤④中粗产品用5%NaOH溶液洗涤的目的是除H2SO 4、HNO3、NO2等物质,
故答案为:除H2SO 4、HNO3、NO2等物质;
点评 本题考查有机物的制备实验,为高频考点,把握有机物的性质、制备原理、混合物分离提纯等为解答的关键,侧重分析与实验能力的考查,注意混合酸的加入顺序,题目难度不大.

练习册系列答案
相关题目
10.类比推理是化学中常用的思维方法.下列推理正确的是( )
| A. | Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3 | |
| B. | CO2与Ba(NO3)2溶液不反应,SO2与Ba(NO3)2溶液也不反应 | |
| C. | CO2是直线型分子,推测CS2也是直线型分子 | |
| D. | NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr |
14.工业制硝酸过程中的一个重要反应为4NH3+5O2 $\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O.下列有关该反应的说法正确的是( )
| A. | O2是还原剂 | B. | NH3是氧化剂 | C. | O2得到电子 | D. | NH3发生还原反应 |
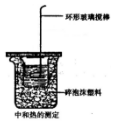 某同学用如图装置做中和热的测定实验
某同学用如图装置做中和热的测定实验