题目内容
10.类比推理是化学中常用的思维方法.下列推理正确的是( )| A. | Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3 | |
| B. | CO2与Ba(NO3)2溶液不反应,SO2与Ba(NO3)2溶液也不反应 | |
| C. | CO2是直线型分子,推测CS2也是直线型分子 | |
| D. | NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr |
分析 A.氯气具有强氧化性,能将变价金属氧化为最高价态,碘单质氧化性较弱,将变价金属氧化为降低价态;
B.碳酸酸性小于硝酸,二氧化硫和硝酸钡发生氧化还原反应;
C.二氧化碳和二硫化碳中C原子价层电子对个数都是2且不含孤电子对,根据价层电子对互斥理论确定两种分子空间构型;
D.浓硫酸具有强氧化性,能氧化HBr.
解答 解:A.氯气具有强氧化性,能将变价金属氧化为最高价态,碘单质氧化性较弱,将变价金属氧化为降低价态,所以Fe与Cl2反应生成FeCl3、Fe与I2反应生成FeI2,故A错误;
B.碳酸酸性小于硝酸,所以二氧化碳不能和硝酸钡溶液反应,二氧化硫和硝酸钡发生氧化还原反应而生成硫酸钡沉淀,故B错误;
C.二氧化碳和二硫化碳中C原子价层电子对个数都是2且不含孤电子对,根据价层电子对互斥理论确定两种分子空间构型都是直线形,故C正确;
D.浓硫酸具有强氧化性,能氧化HBr,所以不能用浓硫酸和NaBr制取HBr,故D错误;
故选C.
点评 本题考查探究化学规律,为高频考点,侧重考查学生分析判断及综合知识灵活运用能力,明确元素化合物性质及性质差异性是解本题关键,注意规律中的异常现象,易错选项是B.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
1.对于容积不变的密闭容器发生中的可逆反应:mX(g)+nY(s)?pZ(g)△H<0,达到平衡后,改变条件,下列表述不正确的是( )
| A. | 增大压强,化学平衡不一定移动 | |
| B. | 通入氦气,化学平衡一定不发生移动 | |
| C. | 增加X或Y的物质的量,化学平衡一定发生移动 | |
| D. | 其它条件不变,升高温度,化学平衡一定发生移动 |
2.下列有关维生素的说法中不正确的是( )
| A. | 维生素是参与生物生长发育和新陈代谢所必需的一类高分子化合物 | |
| B. | 维生素C溶于水,溶液显酸性 | |
| C. | 生吃新鲜蔬菜要比熟吃时维生素C的损失小 | |
| D. | 含维生素C能使蓝色的碘的淀粉溶液褪色 |
 周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中未成对电子有3个,C的最外层电子数为其内层电子数的3倍,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题;
周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中未成对电子有3个,C的最外层电子数为其内层电子数的3倍,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题;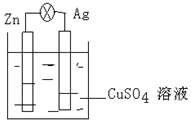 (1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,该电极上发生的电极反应式为Zn-2e-=Zn2+,银电极上发生的是还原反应(“氧化”或“还原”).
(1)在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,该电极上发生的电极反应式为Zn-2e-=Zn2+,银电极上发生的是还原反应(“氧化”或“还原”). .
.