题目内容
11. 某溶液可能含有如表离子
某溶液可能含有如表离子| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | SO42-、OH- |
提示:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O
请回答下列问题:
(1)产生的气体是NH3和O2.
(2)上述溶液中一定存在的离子是H+、Al3+、NH4+、Mg2+、SO42-.图中横坐标字母c=9mol.
(3)加Na2O2固体到bmol时所得沉淀的化学式Mg(OH)2和Al(OH)3.
(4)用离子方程式表示加Na2O2固体到amol前没有出现沉淀的原因2Na2O2+4H+=4Na+2H2O+O2↑.
(5)检验溶液中还可能大量含有的离子,其具体操作是用铂丝蘸蘸取溶液在无色火焰上灼烧,透过蓝色钴玻璃观察火焰颜色,若呈紫色,则证明有K+,反之,则证明没有K+.
分析 根据图象中沉淀先增加后部分溶解可知:溶液中一定含有:Mg2+和Al3+,所以一定不含OH-,加入8mol过氧化钠会生成4mol氧气,而图象中生成了6mol气体,说明生成的气体除了过氧化钠和溶液反应生成的氧气之外,还一定有2mol其他气体生成,而只能是氨气,所以一定含有2mol铵根离子,所以根据电荷守恒可知一定含有SO42-,图象中加入过氧化钠的物质的量在0~amol之间时,没有沉淀生成,所以溶液中含有H+,钾离子不能确定是否存在,
(1)根据以上分析判断;
(2)根据分析判断溶液中的离子;当过氧化钠物质的量为c时,沉淀减少2mol,发生的反应Al(OH)3+OH-═AlO2-+2H2O,据此计算氢氧化钠的物质的量和过氧化钠的物质的量,然后求出c;
(3)生成的沉淀有两种,Mg(OH)2和Al(OH)3;
(4)图象中加入过氧化钠的物质的量在0~amol之间时,没有沉淀生成,所以溶液中含有H+;
(5)钾离子不能确定是否存在,可以用焰色反应检验.
解答 解:根据图象中沉淀先增加后部分溶解可知:溶液中一定含有:Mg2+和Al3+,所以一定不含OH-,加入8mol过氧化钠会生成4mol氧气,而图象中生成了6mol气体,说明生成的气体除了过氧化钠和溶液反应生成的氧气之外,还一定有2mol其他气体生成,而只能是氨气,所以一定含有2mol铵根离子,所以根据电荷守恒可知一定含有SO42-,图象中加入过氧化钠的物质的量在0~amol之间时,没有沉淀生成,所以溶液中含有H+,钾离子不能确定是否存在,
(1)根据以上分析可知,产生的气体是NH3和O2;故答案为:O2;
(2)由分析可知溶液中存在的离子有:H+、Al3+、NH4+、Mg2+、SO42-;当过氧化钠物质的量为c时,沉淀减少2mol,即Al(OH)3为2mol,发生的反应Al(OH)3+OH-═AlO2-+2H2O,则消耗的NaOH为2mol,所以过氧化钠为1mol,则c=8+1=9;
故答案为:H+、Al3+、NH4+、Mg2+、SO42-;9;
(3)加Na2O2固体到bmol时所得的沉淀有两种,Mg(OH)2和Al(OH)3;故答案为:Mg(OH)2和Al(OH)3;.
(4)图象中加入过氧化钠的物质的量在0~amol之间时,没有沉淀生成,所以溶液中含有H+,发生的反应的离子方程式为:2Na2O2+4H+=4Na+2H2O+O2↑;
故答案为:2Na2O2+4H+=4Na+2H2O+O2↑;
(5)钾离子不能确定是否存在,可以用焰色反应检验,具体操作是用铂丝蘸蘸取少量溶液在无色火焰上灼烧,透过蓝色钴玻璃观察火焰颜色,若呈紫色,则证明有K+,反之,则证明没有K+,
故答案为:用铂丝蘸蘸取少量溶液在无色火焰上灼烧,透过蓝色钴玻璃观察火焰颜色,若呈紫色,则证明有K+,反之,则证明没有K+.
点评 本题考查了常见的离子检验方法、离子方程式的书写,题目难度中等,注意掌握常见的离子检验方法,能够根据描述的反应现象判断存在的离子,注意掌握氢氧化铝的两性及反应的方程式.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
| A. | C1极电极与铅蓄电池的Pb电极相接,C2极与铅蓄电池的PbO2电极相接 | |
| B. | 当C1极产生标准状况下11.2 L气体时,铅蓄电池的负极增重64g | |
| C. | A溶液为氢氧化钠溶液,B溶液为硫酸 | |
| D. | 该电解反应的总方程式可以表示为:2Na2SO4+6H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑ |

已知:(1)步骤?5MnO2+2CuFeS2+10H2SO4═5MnSO4+Fe2(SO4)3+2CuSO4+4S↓+10H2O
?部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 | Fe(OH)2 |
| 开始沉淀pH | 4.2 | 1.5 | 7.3 | 6.4 |
| 完全沉淀pH | 6.7 | 3.2 | 9.8 | 9.0 |
(1)步骤?①中每生成64g硫,转移电子的数目为5NA;
(2)步骤?②中pH的范围是3.2≤pH<4.2或3.2<pH<4.2,沉淀E主要成分的化学式为Fe(OH)3;
(3)MnSO4溶液中c(MnSO4)=3×10-6mol/L,某碳酸盐溶液中c(CO32-)=3.3×10-5mol/L,若两溶液按体积比2:1混合,恰好达到溶解平衡,则MnCO3的Ksp=2.2×10-11;
(4)步骤④发生的离子反应方程式:Mn2++2NH3+CO2+H2O=MnCO3↓+2NH4+;
(5)称取0.58g软锰矿于烧杯中,再分别向烧杯中加入过量20.00mL0.1000mol/LNa2C2O4溶液和过量的硫酸,充分搅拌溶解,过滤,将滤液转移至锥形瓶中,用0.1000mol/L的KMnO4溶液滴定至终点,消耗了4.00mLKMnO4溶液.有关反应如下:
MnO2+Na2C2O4+2H2SO4═MnSO4+Na2SO4+2CO2↑+2H2O
5Na2C2O4+2KMnO4+8H2SO4═2MnSO4+K2SO4+5Na2SO4+10CO2↑+8H2O
①实验过程中,若在滴定前滴定管尖嘴部分无气泡,滴定后滴定管尖嘴部分产生了气泡,则会使滴定时消耗的KMnO4溶液体积偏大(填“偏大”、“偏小”或“不变”).
②计算软锰矿中MnO2 的百分含量:15.0%.
| A. | 02是氧化剂,PtF6是还原剂 | |
| B. | 02 (PtF6)中氧元素的化合价为+1 | |
| C. | 02( PtF6)中不存在共价键 | |
| D. | 每生成1 mol O2 (PtF6)则转移1 mol电子 |
| A. | 某H2S04溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×l0-8,由水电离出的c(H+)=1×10-11 mol•L-1 | |
| B. | 将0.02 mol.L-1 HCI溶液与0.02 mol•L-l Ba( OH)2溶液等体积混合后,溶液pH约为12 | |
| C. | 将一定体积稀盐酸与稀氨水混合,当溶质为NH3•H20和NH4Cl时,溶液的pH≥7 | |
| D. | 向0.1 mol•L-1 Na2C03溶液中逐滴滴加0.1 mol•L-1稀盐酸,溶液中c(HCO3-)先增大后减小 |
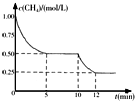 密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )
密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )| A. | 0~5 min内,v(H2)=0.1 mol/(L•min) | |
| B. | 10 min时改变的外界条件可能是升高温度 | |
| C. | 恒温下,缩小容器体积,平衡后c(H2)减小 | |
| D. | 12 min时反应达平衡的本质原因是气体总质量不再变化 |
| A. | l mol H20最多可形成氢键数目为2NA | |
| B. | 标准状况下,11.2 L甲醛所含的σ键数目为2NA | |
| C. | 常温下,46 g N02所含分子数目为NA | |
| D. | pH=l的硫酸中所含S042-的数目为0.05NA |
| A. | 碳原子易失去最外层的电子形成离子 | |
| B. | 碳原子最外层电子易于其他原子的外层电子形成共同电子对 | |
| C. | 组成有机物的碳原子可以形成单键、双键和三键等多种成键形式 | |
| D. | 组成有机物的氧原子、氮原子、卤素原子分别形成2个、3个、1个共价键 |