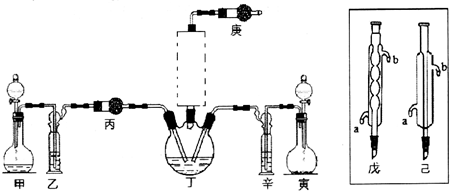
题目内容
19.采用硫酸同槽浸出软锰矿(主要成分MnO2)和黄铜矿(主要成分CuFeS2)的新工艺方法提取锰、铜、铁元素获得成功,生产流程如图所示: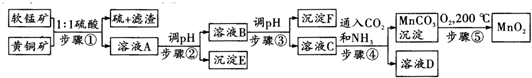
已知:(1)步骤?5MnO2+2CuFeS2+10H2SO4═5MnSO4+Fe2(SO4)3+2CuSO4+4S↓+10H2O
?部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 | Fe(OH)2 |
| 开始沉淀pH | 4.2 | 1.5 | 7.3 | 6.4 |
| 完全沉淀pH | 6.7 | 3.2 | 9.8 | 9.0 |
(1)步骤?①中每生成64g硫,转移电子的数目为5NA;
(2)步骤?②中pH的范围是3.2≤pH<4.2或3.2<pH<4.2,沉淀E主要成分的化学式为Fe(OH)3;
(3)MnSO4溶液中c(MnSO4)=3×10-6mol/L,某碳酸盐溶液中c(CO32-)=3.3×10-5mol/L,若两溶液按体积比2:1混合,恰好达到溶解平衡,则MnCO3的Ksp=2.2×10-11;
(4)步骤④发生的离子反应方程式:Mn2++2NH3+CO2+H2O=MnCO3↓+2NH4+;
(5)称取0.58g软锰矿于烧杯中,再分别向烧杯中加入过量20.00mL0.1000mol/LNa2C2O4溶液和过量的硫酸,充分搅拌溶解,过滤,将滤液转移至锥形瓶中,用0.1000mol/L的KMnO4溶液滴定至终点,消耗了4.00mLKMnO4溶液.有关反应如下:
MnO2+Na2C2O4+2H2SO4═MnSO4+Na2SO4+2CO2↑+2H2O
5Na2C2O4+2KMnO4+8H2SO4═2MnSO4+K2SO4+5Na2SO4+10CO2↑+8H2O
①实验过程中,若在滴定前滴定管尖嘴部分无气泡,滴定后滴定管尖嘴部分产生了气泡,则会使滴定时消耗的KMnO4溶液体积偏大(填“偏大”、“偏小”或“不变”).
②计算软锰矿中MnO2 的百分含量:15.0%.
分析 软锰矿(主要成分MnO2)和黄铜矿(主要成分CuFeS2)中加入硫酸发生氧化还原反应生成硫,溶液A中含有铁离子、铜离子、锰离子等,调节溶液的pH值3.2~4.2,使铁离子生成沉淀E为氢氧化铁,从而除去溶液中的铁离子,过滤后再调节溶液的pH值6.7~7.3,使铜离子生成沉淀F为氢氧化铜,从而除去溶液中的铜离子,过滤后在滤液中通入二氧化碳和氨气,可以获得碳酸锰沉淀,碳酸锰在氧气中加热生成二氧化锰,据此答题.
解答 解:软锰矿(主要成分MnO2)和黄铜矿(主要成分CuFeS2)中加入硫酸发生氧化还原反应生成硫,溶液A中含有铁离子、铜离子、锰离子等,调节溶液的pH值3.2~4.2,使铁离子生成沉淀E为氢氧化铁,从而除去溶液中的铁离子,过滤后再调节溶液的pH值6.7~7.3,使铜离子生成沉淀F为氢氧化铜,从而除去溶液中的铜离子,过滤后在滤液中通入二氧化碳和氨气,可以获得碳酸锰沉淀,碳酸锰在氧气中加热生成二氧化锰,
(1)CuFeS2中硫显-2价,铁显+2价,被氧化后,硫变为0价,铁变为+3价,所以步骤①?中每生成64g即2mol硫,转移电子的数目为5NA,
故答案为:5NA;
(2)步骤?②的目的是使铁离子沉淀完全,且不能使铜离子沉淀完全,所以?②中pH的范围是3.2≤pH<4.2或3.2<pH<4.2,根据上面的分析可知,沉淀E主要成分的化学式为Fe(OH)3,
故答案为:3.2≤pH<4.2或3.2<pH<4.2;Fe(OH)3;
(3)MnSO4溶液中c(MnSO4)=3×10-6mol/L,某碳酸盐溶液中c(CO32-)=3.3×10-5mol/L,若两溶液按体积比2:1混合,恰好达到溶解平衡,则MnCO3的Ksp=[Mn2+]•[CO32-]=$\frac{3×10{\;}^{-6}×2}{3}$×$\frac{3.3×10{\;}^{-5}}{3}$=2.2×10-11,
故答案为:2.2×10-11;
(4)向含有锰离的盐中通入二氧化碳和氨气,可以获得碳酸锰沉淀,原理为:Mn2++2NH3+CO2+H2O=MnCO3↓+2NH4+,
故答案为:Mn2++2NH3+CO2+H2O=MnCO3↓+2NH4+;
(5)①实验过程中,若在滴定前滴定管尖嘴部分无气泡,滴定后滴定管尖嘴部分产生了气泡,则会使滴定时消耗的KMnO4溶液体积偏小,
故答案为:偏小;
②0.1000mol•L-1的KMnO4溶液滴定至终点,消耗了4.00mL KMnO4的溶液,则草酸钠的剩余量=0.1000mol•L-1×0.004L×$\frac{5}{2}$=0.001mol,所以反应掉的草酸钠的量是0.001mol,根据反应MnO2+Na2C2O4+2H2SO4=MnSO4+Na2SO4+2CO2↑+2H2O,0.001mol Na2C2O4溶液消耗掉的二氧化锰的物质的量为0.001mol,所以软锰矿中MnO2的百分含量=$\frac{0.001mol×87g/mol}{0.58g}$×100%=15.0%,
故答案为:15.0%.
点评 本题是一道物质的分离和提纯知识的综合题目,要求学生具有分析和解决问题的能力,综合性较强,难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 白醋中滴入石蕊溶液呈红色 | |
| B. | 白醋加入豆浆中有沉淀产生 | |
| C. | 蛋壳浸泡在白醋中有气体放出 | |
| D. | 测得白醋溶液中的c(H+)在1×10-2 mol•L-1到1×10-3 mol•L-1之间 |
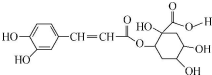
| A. | 每个分子中含有4个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1mol该有机物只能与1molBr2发生反应 | |
| D. | 1mol该有机物最多与8molNaOH反应 |
| A. | +2 | B. | +3 | C. | +6 | D. | +7 |
 某溶液可能含有如表离子
某溶液可能含有如表离子| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | SO42-、OH- |
提示:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O
请回答下列问题:
(1)产生的气体是NH3和O2.
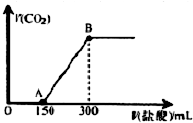
(2)上述溶液中一定存在的离子是H+、Al3+、NH4+、Mg2+、SO42-.图中横坐标字母c=9mol.
(3)加Na2O2固体到bmol时所得沉淀的化学式Mg(OH)2和Al(OH)3.
(4)用离子方程式表示加Na2O2固体到amol前没有出现沉淀的原因2Na2O2+4H+=4Na+2H2O+O2↑.
(5)检验溶液中还可能大量含有的离子,其具体操作是用铂丝蘸蘸取溶液在无色火焰上灼烧,透过蓝色钴玻璃观察火焰颜色,若呈紫色,则证明有K+,反之,则证明没有K+.
 Ⅰ、如果配制3mol/L的NaOH溶液500mL,需称量NaOH固体60.0g.
Ⅰ、如果配制3mol/L的NaOH溶液500mL,需称量NaOH固体60.0g.