题目内容
11.用一种试剂就能把Na2SO4、Na2SO3、Na2CO3、Na2S、BaCl2溶液区别开来,这种试剂是( )| A. | CaCl2溶液 | B. | AgNO3溶液 | C. | H2SO4溶液 | D. | 稀盐酸 |
分析 Na2SO4、Na2SO3、Na2CO3、Na2S、BaCl2分别与硫酸反应的现象为:无现象、刺激性气体、无色无味气体、臭鸡蛋气味的气体、白色沉淀,以此来解答.
解答 解:A.Na2SO4、Na2SO3、Na2CO3均与氯化钙反应生成白色沉淀,不能鉴别,故A不选;
B.Na2SO4、Na2SO3、Na2CO3、BaCl2均与硝酸银反应生成白色沉淀,不能鉴别,故B不选;
C.Na2SO4、Na2SO3、Na2CO3、Na2S、BaCl2分别与硫酸反应的现象为:无现象、刺激性气体、无色无味气体、臭鸡蛋气味的气体、白色沉淀,现象不同可鉴别,故C选;
D.Na2SO4、BaCl2均与稀盐酸不反应,不能鉴别,故D不选;
故选C.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.已知${\;}_{58}^{140}$Ce是地壳中含量最高的稀土金属元素.下列关于${\;}_{58}^{140}$Ce的说法正确的是( )
| A. | 质量数为198 | B. | 中子数为82 | ||
| C. | 与${\;}_{58}^{142}$Ce为同素异形体 | D. | Ce元素相对原子质量为140 |
2.下列化学用语表示正确的是( )
| A. | 氯气的电子式:Cl:Cl | |
| B. | NH4Cl的电子式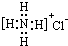 | |
| C. | 钠原子的结构示意图: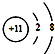 | |
| D. | 硫酸亚铁的电离方程式FeSO4═Fe2++SO42- |
19.下列图示与对应的叙述不相符的是( )
| A. |  表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化 | |
| B. | 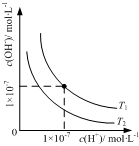 表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2<T1 | |
| C. | 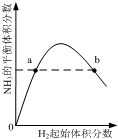 表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 | |
| D. | 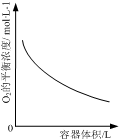 表示同一温度下,在不同容积的容器中进行反应2NO2(g)?2NO(g)+O2(g),O2的平衡浓度与容器容积的关系 |
5.用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取2.1g烧碱样品,所用主要仪器是托盘天平、药匙、烧杯;
(2)将样品配成250mL待测液,除了用到烧杯、玻璃棒、胶头滴管外,还需要的玻璃仪器是:250mL容量瓶;
(3)取10.00mL待测液于锥形瓶中,应该用碱式滴定管量取;
(4)用0.1000mol•L-1标准盐酸滴定待测烧碱溶液,该盐酸的pH=1,
选用酚酞为指示剂,滴定时,左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到滴入一滴标准盐酸时溶液溶液由红色变为无色,且半分钟内不褪色(填现象),达到滴定终点;
(5)下列操作会造成测定结果偏高的是C.
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.摇动锥形瓶时,瓶内有少量的液体溅出.
(6)根据下列数据,可计算出待测烧碱溶液的物质的量浓度为:0.2000mol•L-1;
(7)根据表中数据,可计算出烧碱的纯度为:95.2%;[已知:烧碱的摩尔质量为40g/mol.].
(1)准确称取2.1g烧碱样品,所用主要仪器是托盘天平、药匙、烧杯;
(2)将样品配成250mL待测液,除了用到烧杯、玻璃棒、胶头滴管外,还需要的玻璃仪器是:250mL容量瓶;
(3)取10.00mL待测液于锥形瓶中,应该用碱式滴定管量取;
(4)用0.1000mol•L-1标准盐酸滴定待测烧碱溶液,该盐酸的pH=1,
选用酚酞为指示剂,滴定时,左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到滴入一滴标准盐酸时溶液溶液由红色变为无色,且半分钟内不褪色(填现象),达到滴定终点;
(5)下列操作会造成测定结果偏高的是C.
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.摇动锥形瓶时,瓶内有少量的液体溅出.
(6)根据下列数据,可计算出待测烧碱溶液的物质的量浓度为:0.2000mol•L-1;
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
2.青蒿素是烃的含氧衍生物,为无色针状晶体.易溶于丙酮、氯仿和苯中,在水中几乎不溶,熔点为156-157℃.青蒿素是有效的抗疟药.从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法.
乙醚浸取法的主要工艺为:

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率.
(2)操作I的名称是过滤,操作II的名称是蒸馏.
(3)用下列实验装置测定青蒿素的分子式,将28.2g青蒿素放在硬质玻璃管C中充分燃烧:

①装置E中盛放的物质是无水CaCl2或P2O5,装置F中盛放的物质是碱石灰.
②该实验装置可能产生误差,造成测定含氧量偏低,改进方法是除去装置左侧通入的空气中的CO2和水蒸气,在装置F后加一个防止空气中的CO2和水蒸气进入F的装置.
③已知青蒿素是烃的含氧衍生物,用合理改进后的装置进行实验,称得:
青蒿素的最简式是C15H22O5.
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与C(填字母)具有相似的性质.
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖.
乙醚浸取法的主要工艺为:

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率.
(2)操作I的名称是过滤,操作II的名称是蒸馏.
(3)用下列实验装置测定青蒿素的分子式,将28.2g青蒿素放在硬质玻璃管C中充分燃烧:

①装置E中盛放的物质是无水CaCl2或P2O5,装置F中盛放的物质是碱石灰.
②该实验装置可能产生误差,造成测定含氧量偏低,改进方法是除去装置左侧通入的空气中的CO2和水蒸气,在装置F后加一个防止空气中的CO2和水蒸气进入F的装置.
③已知青蒿素是烃的含氧衍生物,用合理改进后的装置进行实验,称得:
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与C(填字母)具有相似的性质.
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖.
3.利用海洋资源获得的部分物质如图所示.下列说法正确的是( )
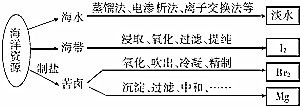

| A. | 从海水中获取淡水,历史最久的方法是离子交换法 | |
| B. | 从海带中获得I2需要用到的主要仪器有蒸发皿、漏斗、烧杯、分液漏斗等 | |
| C. | 用SO2溶液吸收从苦卤中吹出的单质溴时,发生的离子反应是Br2+SO2+2H2O═4H++SO42-+2Br- | |
| D. | 用石灰石、盐酸等从苦卤中提取镁时,发生反应的反应类型有化合、分解、置换和复分解 |
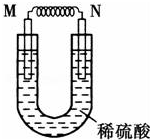 由铜片、铁片和200mL稀H2SO4组成的原电池中(如图),若铁片只发生电化学反应,则当N极上放出2.8L(标准状况)气体时,则M电极材料为Fe,其电极反应式为Fe-2e-=Fe2+,反应结束时,导线上转移电子的物质的量为0.25mol.
由铜片、铁片和200mL稀H2SO4组成的原电池中(如图),若铁片只发生电化学反应,则当N极上放出2.8L(标准状况)气体时,则M电极材料为Fe,其电极反应式为Fe-2e-=Fe2+,反应结束时,导线上转移电子的物质的量为0.25mol.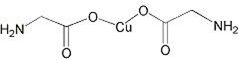 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备: