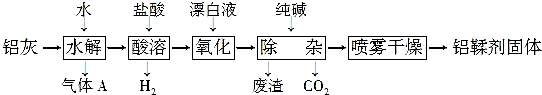
题目内容
2.下列化学用语表示正确的是( )| A. | 氯气的电子式:Cl:Cl | |
| B. | NH4Cl的电子式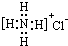 | |
| C. | 钠原子的结构示意图: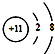 | |
| D. | 硫酸亚铁的电离方程式FeSO4═Fe2++SO42- |
分析 A.氯气中存在1对氯氯共用电子对,氯原子最外层达到8电子稳定结构;
B.氯化铵为离子化合物,铵根离子与氯离子通过离子键结合,氯离子电子式书写错误;
C.钠原子核内有11个质子,核外有11个电子;
D.硫酸亚铁为强电解质,完全电离产生二价铁离子与硫酸根离子;
解答 解:A.氯气分子中存在1个氯氯共用电子对,氯气分子的电子式为: ,故A错误;
,故A错误;
B.氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,故B错误;
,故B错误;
C.钠原子核内有11个质子,核外有3个电子层,第一层上有2个电子、第二层上有8个电子,最外层上有1个电子,其原子结构示意图为: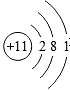 ,故C错误;
,故C错误;
D.硫酸亚铁为强电解质,完全电离产生二价铁离子与硫酸根离子,电离方程式:FeSO4═Fe2++SO42-,故D正确;
故选:D.
点评 本题考查了物质电子式、原子结构示意图、电解质电离方程式的书写,为高考频考题,准确判断物质的结构及掌握电子式书写方法是解题关键,题目难度不大.

练习册系列答案
相关题目
12.可逆反应A(g)+3B(g)?2C(g)+2D(g),在4中不同情况下反应速率分别如下,其中反应速率v最大的是( )
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.02mol/(L•s) | ||
| C. | v(C)=0.01mol/(L•s) | D. | v(D)=0.1mol/(L•min) |
14.用NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 在密闭容器中,加入1.5mol H2和0.5mol N 2充分反应后,可得到NH3分子数为NA | |
| B. | 25℃时,1L pH=1的稀硫酸溶液中含有的H+数目为0.1NA | |
| C. | 1 mol•L-1的NaClO溶液中所含ClO-的数目为NA | |
| D. | 1L 0.1mol•L-1 AlCl3的溶液中所含Al3+的数目为0.1NA |
11.用一种试剂就能把Na2SO4、Na2SO3、Na2CO3、Na2S、BaCl2溶液区别开来,这种试剂是( )
| A. | CaCl2溶液 | B. | AgNO3溶液 | C. | H2SO4溶液 | D. | 稀盐酸 |
 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验. ;
; +H2O、
+H2O、 、
、 .
.