题目内容
3.利用海洋资源获得的部分物质如图所示.下列说法正确的是( )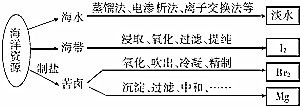
| A. | 从海水中获取淡水,历史最久的方法是离子交换法 | |
| B. | 从海带中获得I2需要用到的主要仪器有蒸发皿、漏斗、烧杯、分液漏斗等 | |
| C. | 用SO2溶液吸收从苦卤中吹出的单质溴时,发生的离子反应是Br2+SO2+2H2O═4H++SO42-+2Br- | |
| D. | 用石灰石、盐酸等从苦卤中提取镁时,发生反应的反应类型有化合、分解、置换和复分解 |
分析 A.海水获取淡水的方法最早是蒸馏方法;
B.由提取海带中的碘的实验流程可知,海带在坩埚中灼烧,然后溶解得到悬浊液,过滤得到含碘离子的溶液加入一家银行碘离子为碘单质,得到含碘单质的溶液,加入萃取剂萃取分液,最后蒸馏,其中过程中不需要蒸发皿;
C.用SO2溶液吸收从苦卤中吹出的单质溴时,利用二氧化硫还原性和溴单质发生氧化还原反应生成溴化氢和硫酸;
D.海水提取镁单质的过程中发生的反应有:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、CaO+H2O=Ca(OH)2、Mg2++2OH-=Mg(OH)2↓、Mg(OH)2+2HCl=MgCl2+2H2O、MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
解答 解:A.从海水中获取淡水历史最悠久的方法是蒸馏,故A错误;
B.提取海带中的碘元素不需要溶液蒸发,不需要蒸发皿,故B错误;
C.用SO2溶液吸收从苦卤中吹出的单质溴时,利用二氧化硫还原性和溴单质发生氧化还原反应生成溴化氢和硫酸,发生的离子反应是Br2+SO2+2H2O═4H++SO42-+2Br-,故C正确;
D.海水提取镁单质的过程中发生的反应有:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、CaO+H2O=Ca(OH)2、Mg2++2OH-=Mg(OH)2↓、Mg(OH)2+2HCl=MgCl2+2H2O、MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,所以涉及的反应有化合反应、复分解反应和分解反应,不涉及置换反应,故D错误;
故选C.
点评 本题考查了海水资源的综合利用,主要是海水获取淡水、提取碘单质、金属镁、溴单质等生产流程的分析判断,掌握基础是解题关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | CaCl2溶液 | B. | AgNO3溶液 | C. | H2SO4溶液 | D. | 稀盐酸 |
| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02mol•L-1AgNO3溶液和0.02mol•L-1Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和AgCl溶液中滴加0.5mL0.1mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1的NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
| A. | 用金属铝进行铝热法炼铁 | B. | 用熟石灰中和土壤的酸性 | ||
| C. | 用NaHCO3治疗胃酸过多 | D. | 用水玻璃制备硅胶和木材防火剂 |
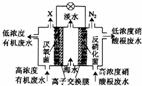 一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法错误的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法错误的是( )| A. | 中间室中的 Cl-向左室移动 | |
| B. | 左、右两室溶液混合后所得溶液的酸性:反应前<反应后 | |
| C. | X气体为CO2 | |
| D. | 左边离子交换膜为阴离子交換膜,右边离子交换膜为阳离子交換膜 |
| A. | S>O>F | B. | S2->Cl->K+>Ca2+ | C. | F->O2->Na+>Mg2+ | D. | Fe>Fe2+>Fe3+ |
| A. | M一定是第VIA族元素 | B. | M的最高价氧化物为RO2 | ||
| C. | M的气态氢化物一定能形成氢键 | D. | M的气态氢化物溶于水可能显碱性 |
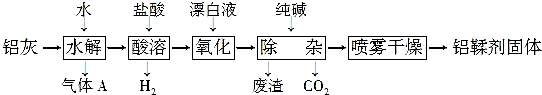

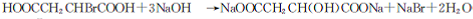 .
. +(n-1)H2O→n HOOCCH2CH(OH)COOH.
+(n-1)H2O→n HOOCCH2CH(OH)COOH.