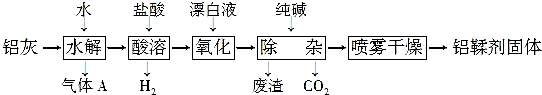
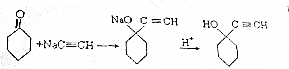题目内容
5.用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:(1)准确称取2.1g烧碱样品,所用主要仪器是托盘天平、药匙、烧杯;
(2)将样品配成250mL待测液,除了用到烧杯、玻璃棒、胶头滴管外,还需要的玻璃仪器是:250mL容量瓶;
(3)取10.00mL待测液于锥形瓶中,应该用碱式滴定管量取;
(4)用0.1000mol•L-1标准盐酸滴定待测烧碱溶液,该盐酸的pH=1,
选用酚酞为指示剂,滴定时,左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到滴入一滴标准盐酸时溶液溶液由红色变为无色,且半分钟内不褪色(填现象),达到滴定终点;
(5)下列操作会造成测定结果偏高的是C.
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.摇动锥形瓶时,瓶内有少量的液体溅出.
(6)根据下列数据,可计算出待测烧碱溶液的物质的量浓度为:0.2000mol•L-1;
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
分析 (1)根据烧碱具有腐蚀性且容易潮解,选择称量时使用的仪器;
(2)根据操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作选择仪器来解答;
(3)根据碱性溶液盛放在碱式滴定管中;
(4)根据pH=-lgc(H+)计算即可;根据滴定时,两眼注视锥形瓶中溶液颜色的变化;如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(5)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(6)先判断数据的有效性,然后求出平均值,最后根据关系式HCl~NaOH来计算出烧碱的浓度;
(7)根据m=CVM计算250mL烧碱样品中氢氧化钠的质量,再根据质量分数公式计算氢氧化钠的质量分数;
解答 解:(1)氢氧化钠容易潮解,具有很强的腐蚀性,称量时应该放在小烧杯中称量,所以称量使用的仪器有:托盘天平、药匙、烧杯;
故答案为:托盘天平、药匙、烧杯;
(2)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,将样品在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器是:烧杯、玻璃棒、250mL容量瓶、胶头滴管;
故答案为:250mL容量瓶;
(3)待测液是碱性溶液,用碱式滴定管量取;
故答案为:碱式滴定管;
(4)0.1000mol•L-1标准盐酸中c(H+)=c(HCl)=0.1mol/L,pH=-lgc(H+)=-lg0.1=1;滴定过程中,两眼注视锥形瓶中溶液颜色的变化,以便及时判断滴定终点;滴定时,当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色,可说明达到滴定终点;
故答案为:1;锥形瓶中溶液颜色的变化;溶液由红色变为无色,且半分钟内不褪色;
(5)A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故A错误;
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,操作正确,无影响,故B错误;
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故C正确;
D.摇动锥形瓶时,瓶内有少量的液体溅出,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故D错误;
故选C;
(6)两次滴定消耗的标准液的体积分别为:19.90mL,20.10mL,两次滴定消耗的标准液的平均体积为20.00mL,
HCl~NaOH
1 1
0.1000mol•L-1×20.00mL c(NaOH)×10.00mL
解得:c(NaOH)=0.2000mol•L-1,
故答案为:0.2000mol•L-1;
(7)准确称取2.1g烧碱样品,将样品配成250mL的待测液,取出10.00mL待测液,依据(6)计算得到NaOH浓度为0.2000mol•L-1,250ml溶液中氢氧化钠物质的量=0.2000mol•L-1×0.250L=0.05mol,氢氧化钠的纯度为=$\frac{0.05mol×40g/mol}{2.1g}$×100%=95.2%;
故答案为:95.2%.
点评 本题主要考查了中和滴定操作、误差分析以及烧碱的纯度的计算,难度中等,注意知识的积累.

| A. | 在密闭容器中,加入1.5mol H2和0.5mol N 2充分反应后,可得到NH3分子数为NA | |
| B. | 25℃时,1L pH=1的稀硫酸溶液中含有的H+数目为0.1NA | |
| C. | 1 mol•L-1的NaClO溶液中所含ClO-的数目为NA | |
| D. | 1L 0.1mol•L-1 AlCl3的溶液中所含Al3+的数目为0.1NA |
| A. | CaCl2溶液 | B. | AgNO3溶液 | C. | H2SO4溶液 | D. | 稀盐酸 |
步骤①用电子天平准确称取样品1.5000g.
步骤②将样品溶解并冷却后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤③移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛,摇匀、静置5min,加入2滴酚酞试液,用NaOH标准溶液滴定到终点.重复步骤③操作2次.
(1)根据步骤③填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数将偏高 (填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积将无影响
(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察B.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变为红色,半分钟内不褪色.
⑤滴定后俯视读数,测得样品中氮的质量分数将偏低(填“偏高”、“偏低”或“无影响”).
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.00 |
| 3 | 25.00 | 0.20 | 20.21 |
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
I.按如图1装置用H2还原无水FeCl3制取.
(1)装置C的作用是干燥氢气;E中盛放的试剂是碱石灰;D中反应的化学方程式为H2+2FeCl3=2FeCl2+2HCl.
(2)温度控制不当,产品中含单质铁.检验产品中是否含铁的方案是取样,加入盐酸中,观察是否有气泡产生.
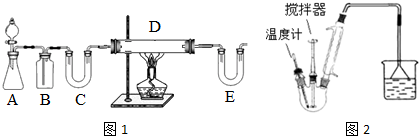
II.按如图2装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128~139℃加热3h,反应接近100%.冷却,分离提纯得到粗产品.反应如下:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl
(3)该制取反应中,作还原剂的是C6H5Cl.
(4)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失.原因是实验使用了冷凝回流装置.
(5)冷却实验装置,将三颈瓶内物质经过过滤、洗涤,干燥后,将得到粗产品.
①洗涤所用的试剂可以是苯;
②回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分.
(6)仅通过烧杯中的现象变化就可以监控氯化铁的转化率.若要监控氯化铁转化率达到或超过90%,则烧杯中加入的试剂可以是滴有酚酞且含18gNaOH的溶液.
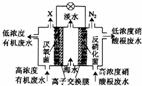 一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法错误的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法错误的是( )| A. | 中间室中的 Cl-向左室移动 | |
| B. | 左、右两室溶液混合后所得溶液的酸性:反应前<反应后 | |
| C. | X气体为CO2 | |
| D. | 左边离子交换膜为阴离子交換膜,右边离子交换膜为阳离子交換膜 |
 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.