题目内容
19.下列图示与对应的叙述不相符的是( )| A. |  表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化 | |
| B. | 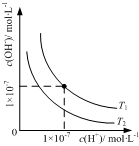 表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2<T1 | |
| C. | 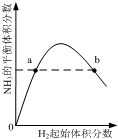 表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 | |
| D. | 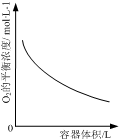 表示同一温度下,在不同容积的容器中进行反应2NO2(g)?2NO(g)+O2(g),O2的平衡浓度与容器容积的关系 |
分析 A.醋酸是弱酸溶液中存在电离平衡,加水稀释平衡正向进行,如稀释10n倍,溶液PH增大数值小于n;
B.水的电离过程是吸热过程,加热促进电离平衡正向进行;一定温度下存在离子积常数;
C.两种反应物增加一种会提高另一种物质的转化率;
D.体积越大压强越小,平衡向气体体积增大的分析进行.
解答 解:A.醋酸是弱酸溶液中存在电离平衡,加水稀释平衡正向进行,如稀释10n倍,溶液PH增大数值小于n,图象中是体积增大10n,溶液PH增大n个单位,不能表示出电离平衡正向进行的变化,图想错误,故A选;
B.水的电离过程是吸热过程,加热促进电离平衡正向进行,氢离子浓度增大,氢氧根离子浓度减小,一定温度下存在离子积常数,温度越高氢离子和氢氧根离子浓度越大,T2<T1,图象变化符合离子浓度变化,故B不选;
C.两种反应物增加一种会提高另一种物质的转化率,随氢气体积分数增大,氮气转化率增大,所以图中a点N2的转化率小于b点,图象变化符合转化率变化,故C不选;
D.2NO2(g)?2NO(g)+O2(g),反应是气体体积增大的反应,体积越大压强越小,平衡向气体体积增大的分析进行,正向进行,但体积增大对浓度影响大,所以氧气平衡浓度减小,图象变化符合反应变化,故D不选;
故选A.
点评 本题考查了弱电解质电离平衡、化学平衡影响因素的分析判断,溶液稀释平衡状态下离子浓度减小,注意体积变化和平衡移动的关系判断,题目难度中等.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
9.乙醛、丙醛组成的混合物中氢元素的质量分数为9%,则氧元素的质量分数( )
| A. | 6% | B. | 16% | C. | 37% | D. | 不能确定 |
14.用NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 在密闭容器中,加入1.5mol H2和0.5mol N 2充分反应后,可得到NH3分子数为NA | |
| B. | 25℃时,1L pH=1的稀硫酸溶液中含有的H+数目为0.1NA | |
| C. | 1 mol•L-1的NaClO溶液中所含ClO-的数目为NA | |
| D. | 1L 0.1mol•L-1 AlCl3的溶液中所含Al3+的数目为0.1NA |
11.用一种试剂就能把Na2SO4、Na2SO3、Na2CO3、Na2S、BaCl2溶液区别开来,这种试剂是( )
| A. | CaCl2溶液 | B. | AgNO3溶液 | C. | H2SO4溶液 | D. | 稀盐酸 |
10.实验室常利用甲醛法测定某(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=4H++(CH2)6N4+6H2O,然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤①用电子天平准确称取样品1.5000g.
步骤②将样品溶解并冷却后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤③移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛,摇匀、静置5min,加入2滴酚酞试液,用NaOH标准溶液滴定到终点.重复步骤③操作2次.
(1)根据步骤③填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数将偏高 (填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积将无影响
(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察B.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变为红色,半分钟内不褪色.
⑤滴定后俯视读数,测得样品中氮的质量分数将偏低(填“偏高”、“偏低”或“无影响”).
(2)滴定结果如下表所示:
若NaOH标准溶液的浓度为0.1000mol•L-1,则该样品中氮的质量分数为18.68%.(保留两位小数)
步骤①用电子天平准确称取样品1.5000g.
步骤②将样品溶解并冷却后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤③移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛,摇匀、静置5min,加入2滴酚酞试液,用NaOH标准溶液滴定到终点.重复步骤③操作2次.
(1)根据步骤③填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数将偏高 (填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积将无影响
(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察B.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变为红色,半分钟内不褪色.
⑤滴定后俯视读数,测得样品中氮的质量分数将偏低(填“偏高”、“偏低”或“无影响”).
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.00 |
| 3 | 25.00 | 0.20 | 20.21 |
11.25℃时,已知Ksp(Ag2SO4)=1.2×10-5,Ksp(AgCl)=1.8×10-10,Ksp(Ag2C2O4)=3.5×10-11,Ksp(AgI)=1.5×10-16,该温度下有关叙述正确的是( )
| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02mol•L-1AgNO3溶液和0.02mol•L-1Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和AgCl溶液中滴加0.5mL0.1mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1的NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
 ;
; +H2O、
+H2O、 、
、 .
.