题目内容
1.已知${\;}_{58}^{140}$Ce是地壳中含量最高的稀土金属元素.下列关于${\;}_{58}^{140}$Ce的说法正确的是( )| A. | 质量数为198 | B. | 中子数为82 | ||
| C. | 与${\;}_{58}^{142}$Ce为同素异形体 | D. | Ce元素相对原子质量为140 |
分析 A.B.根据原子符号的含义以及质量数=质子数+中子数,质子数=核外电子数来解答.
C.同一元素形成的不同单质为同素异形体;根据质子数相同,中子数不同原子,属于同位素;
D.元素的相对原子质量是指元素的平均相对原子质量,它是根据天然同位素原子所占的原子个数百分比和其相对原子质量计算出的平均值;
解答 解:A.${\;}_{58}^{140}$Ce的质量数为140,故A错误;
B.${\;}_{58}^{140}$Ce的质子数为58,质量数为140,中子数为140-58=82,故B正确;
C.${\;}_{58}^{140}$Ce与${\;}_{58}^{142}$Ce的质子数相同,中子数不同,属于同位素,故C错误;
D.根据一种核素的相对原子质量,无法求出Ce元素相对原子质量,故D错误;
故选B.
点评 本题主要考查了原子符号的含义以及质量数=质子数+中子数,质子数=核外电子数,题目较简单.

练习册系列答案
相关题目
12.可逆反应A(g)+3B(g)?2C(g)+2D(g),在4中不同情况下反应速率分别如下,其中反应速率v最大的是( )
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.02mol/(L•s) | ||
| C. | v(C)=0.01mol/(L•s) | D. | v(D)=0.1mol/(L•min) |
9.乙醛、丙醛组成的混合物中氢元素的质量分数为9%,则氧元素的质量分数( )
| A. | 6% | B. | 16% | C. | 37% | D. | 不能确定 |
16.下列表中括号内的物质为所含的少量杂质,请选用最佳试剂和分离方法将杂质除去.
| 需加入的试剂 | 分离方法 | |
| 乙烷(乙烯) | ||
| 乙醇(水) | ||
| 苯(苯酚) |
6.可逆反应2NO2?2NO+O2在恒容密闭容器中进行,下列情况达到平衡状态的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②混合气体的平均相对分子质量不再改变
③NO2、NO、O2的反应速率之比为2:2:1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体压强不再改变.
①单位时间内生成n mol O2的同时生成2n mol NO2
②混合气体的平均相对分子质量不再改变
③NO2、NO、O2的反应速率之比为2:2:1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体压强不再改变.
| A. | ①②④⑥ | B. | ②③⑤ | C. | ①②⑤⑥ | D. | ①②④⑤ |
11.用一种试剂就能把Na2SO4、Na2SO3、Na2CO3、Na2S、BaCl2溶液区别开来,这种试剂是( )
| A. | CaCl2溶液 | B. | AgNO3溶液 | C. | H2SO4溶液 | D. | 稀盐酸 |
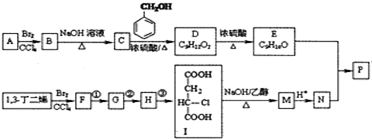
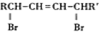 (R、R′表示烃基)
(R、R′表示烃基) (其中R1~R2表示氢或烃基)
(其中R1~R2表示氢或烃基) .
. .
. (其中任一种).
(其中任一种). 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.