题目内容
14.咖啡和茶叶中富含漂木酸,它具有抗癌作用,其结构简式如图.下列有关说法正确的是( )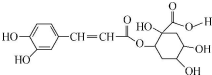
| A. | 每个分子中含有4个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1mol该有机物只能与1molBr2发生反应 | |
| D. | 1mol该有机物最多与8molNaOH反应 |
分析 A.连接四个不同原子或原子团的碳原子为手性碳原子;
B.酚能和氯化铁溶液发生显色反应;
C.苯环上 酚羟基邻对位氢原子能和溴发生取代反应,碳碳双键能和溴发生加成反应;
D.酚羟基和羧基、酯基水解生成的羧基能和NaOH反应.
解答 解:A.连接四个不同原子或原子团的碳原子为手性碳原子,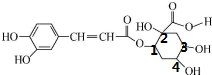 中有4个手性碳原子,故A正确;
中有4个手性碳原子,故A正确;
B.酚能和氯化铁溶液发生显色反应,该物质含有酚羟基,所以能和氯化铁溶液发生显色反应,故B正确;
C.苯环上 酚羟基邻对位氢原子能和溴发生取代反应,碳碳双键能和溴发生加成反应,1mol该有机物只能与4molBr2发生反应,故C错误;
D.酚羟基和羧基、酯基水解生成的羧基能和NaOH反应,1mol该有机物最多与4molNaOH反应,故D错误;
故选AB.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查酚、烯烃、酯和羧酸性质,注意酚和溴发生取代反应位置,易错选项是C.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列解释事实或实验现象的化学用语正确的是( )
| A. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 酸性KI淀粉溶液久置后变蓝 4I-+O2+2H2O═2I2+4OH- | |
| C. | 实验室盛装NaOH溶液的试剂瓶不能用玻璃塞SiO2+2OH-═SiO32-+H2O | |
| D. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
2.双隔膜电解池的结构示意简图如图所示,利用铅蓄电池电解Na2SO4溶液可以制取H2SO4和NaOH,并得到H2和O2,.对该装置及其原理判断中,不正确的是( )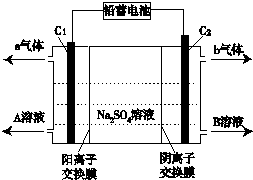

| A. | C1极电极与铅蓄电池的Pb电极相接,C2极与铅蓄电池的PbO2电极相接 | |
| B. | 当C1极产生标准状况下11.2 L气体时,铅蓄电池的负极增重64g | |
| C. | A溶液为氢氧化钠溶液,B溶液为硫酸 | |
| D. | 该电解反应的总方程式可以表示为:2Na2SO4+6H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑ |
9.下列关于化学用语的表示正确的是( )
| A. | 制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| B. | 乙醇的结构简式:C2H6O | |
| C. | CO2的比例模型: | |
| D. | 质子数为8,质量数为17的原子:${\;}_{8}^{17}$Cl |
19.采用硫酸同槽浸出软锰矿(主要成分MnO2)和黄铜矿(主要成分CuFeS2)的新工艺方法提取锰、铜、铁元素获得成功,生产流程如图所示:
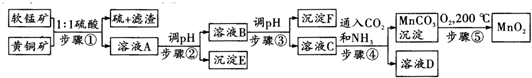
已知:(1)步骤?5MnO2+2CuFeS2+10H2SO4═5MnSO4+Fe2(SO4)3+2CuSO4+4S↓+10H2O
?部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
根据表中数据,回答相关问题:
(1)步骤?①中每生成64g硫,转移电子的数目为5NA;
(2)步骤?②中pH的范围是3.2≤pH<4.2或3.2<pH<4.2,沉淀E主要成分的化学式为Fe(OH)3;
(3)MnSO4溶液中c(MnSO4)=3×10-6mol/L,某碳酸盐溶液中c(CO32-)=3.3×10-5mol/L,若两溶液按体积比2:1混合,恰好达到溶解平衡,则MnCO3的Ksp=2.2×10-11;
(4)步骤④发生的离子反应方程式:Mn2++2NH3+CO2+H2O=MnCO3↓+2NH4+;
(5)称取0.58g软锰矿于烧杯中,再分别向烧杯中加入过量20.00mL0.1000mol/LNa2C2O4溶液和过量的硫酸,充分搅拌溶解,过滤,将滤液转移至锥形瓶中,用0.1000mol/L的KMnO4溶液滴定至终点,消耗了4.00mLKMnO4溶液.有关反应如下:
MnO2+Na2C2O4+2H2SO4═MnSO4+Na2SO4+2CO2↑+2H2O
5Na2C2O4+2KMnO4+8H2SO4═2MnSO4+K2SO4+5Na2SO4+10CO2↑+8H2O
①实验过程中,若在滴定前滴定管尖嘴部分无气泡,滴定后滴定管尖嘴部分产生了气泡,则会使滴定时消耗的KMnO4溶液体积偏大(填“偏大”、“偏小”或“不变”).
②计算软锰矿中MnO2 的百分含量:15.0%.

已知:(1)步骤?5MnO2+2CuFeS2+10H2SO4═5MnSO4+Fe2(SO4)3+2CuSO4+4S↓+10H2O
?部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 | Fe(OH)2 |
| 开始沉淀pH | 4.2 | 1.5 | 7.3 | 6.4 |
| 完全沉淀pH | 6.7 | 3.2 | 9.8 | 9.0 |
(1)步骤?①中每生成64g硫,转移电子的数目为5NA;
(2)步骤?②中pH的范围是3.2≤pH<4.2或3.2<pH<4.2,沉淀E主要成分的化学式为Fe(OH)3;
(3)MnSO4溶液中c(MnSO4)=3×10-6mol/L,某碳酸盐溶液中c(CO32-)=3.3×10-5mol/L,若两溶液按体积比2:1混合,恰好达到溶解平衡,则MnCO3的Ksp=2.2×10-11;
(4)步骤④发生的离子反应方程式:Mn2++2NH3+CO2+H2O=MnCO3↓+2NH4+;
(5)称取0.58g软锰矿于烧杯中,再分别向烧杯中加入过量20.00mL0.1000mol/LNa2C2O4溶液和过量的硫酸,充分搅拌溶解,过滤,将滤液转移至锥形瓶中,用0.1000mol/L的KMnO4溶液滴定至终点,消耗了4.00mLKMnO4溶液.有关反应如下:
MnO2+Na2C2O4+2H2SO4═MnSO4+Na2SO4+2CO2↑+2H2O
5Na2C2O4+2KMnO4+8H2SO4═2MnSO4+K2SO4+5Na2SO4+10CO2↑+8H2O
①实验过程中,若在滴定前滴定管尖嘴部分无气泡,滴定后滴定管尖嘴部分产生了气泡,则会使滴定时消耗的KMnO4溶液体积偏大(填“偏大”、“偏小”或“不变”).
②计算软锰矿中MnO2 的百分含量:15.0%.
6.已知如下反应:02+PtF6=02( PtF6),已知02(PtF6)为离子化合物,其中Pt的化合价为+5,对于此反应,下列说法正确的是( )
| A. | 02是氧化剂,PtF6是还原剂 | |
| B. | 02 (PtF6)中氧元素的化合价为+1 | |
| C. | 02( PtF6)中不存在共价键 | |
| D. | 每生成1 mol O2 (PtF6)则转移1 mol电子 |
3.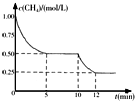 密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )
密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )
 密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )
密闭容器中有反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)变化如右图所示.下列判断正确的是( )| A. | 0~5 min内,v(H2)=0.1 mol/(L•min) | |
| B. | 10 min时改变的外界条件可能是升高温度 | |
| C. | 恒温下,缩小容器体积,平衡后c(H2)减小 | |
| D. | 12 min时反应达平衡的本质原因是气体总质量不再变化 |
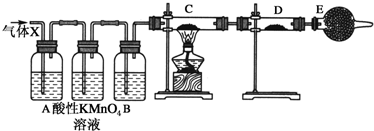
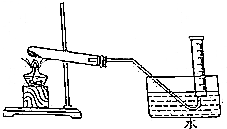 为验证MnO2在KClO3受热分解制O2的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:
为验证MnO2在KClO3受热分解制O2的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验: