题目内容
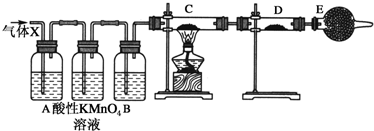
19.常见无机物A、B、C、D、E、X存在如图转化关系.已知A、B、C、D的焰色反应都呈黄色,其中A为单质,X是常见的无色无味气体.(部分生成物和反应条件略去)请回答: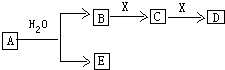
(1)组成单质A的元素符号为Na,E的电子式
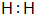 .
.(2)写出由C转化为D的化学方程式CO2+Na2CO3+H2O=2NaHCO3.
分析 A、B、C、D的焰色反应都呈黄色,均含有Na元素,其中A为单质,则A为Na,与水反应生成NaOH与氢气,可推知E为H2,B为NaOH,X是常见的无色无味气体,能与NaOH连续反应,可知X为CO2,C为Na2CO3,D为NaHCO3,据此解答.
解答 解:A、B、C、D的焰色反应都呈黄色,均含有Na元素,其中A为单质,则A为Na,与水反应生成NaOH与氢气,可推知E为H2,B为NaOH,X是常见的无色无味气体,能与NaOH连续反应,可知X为CO2,C为Na2CO3,D为NaHCO3.
(1)组成单质A的元素符号为Na,E为H2,电子式为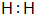 ,故答案为:Na;
,故答案为:Na;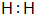 ;
;
(2)由C转化为D的化学方程式:CO2+Na2CO3+H2O=2NaHCO3,故答案为:CO2+Na2CO3+H2O=2NaHCO3.
点评 本题考查无机物的推断,涉及钠元素单质化合物性质,物质的焰色反应为推断突破口,难度不大,旨在考查学生对基础知识的掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列关于化学用语的表示正确的是( )
| A. | 制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| B. | 乙醇的结构简式:C2H6O | |
| C. | CO2的比例模型: | |
| D. | 质子数为8,质量数为17的原子:${\;}_{8}^{17}$Cl |
10.实验室存放药品采用分类的方法进行,Na2CO3是实验室常用的一种重要试剂,它不属于下列分类中的( )
| A. | 正盐 | B. | 碱 | C. | 钠盐 | D. | 碳酸盐 |
14.下列有关说法正确的是( )
| A. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全杀灭该病毒感染,其消毒原理和漂白粉消毒饮用水相同 | |
| B. | PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,2015年初公益调查《柴静雾霾调查:穹顶之下》发布,引起社会强烈反响,PM2.5引起的雾霾一定属于气溶胶. | |
| C. | 陶瓷、玻璃和光导纤维都是硅酸盐材料 | |
| D. | 原子结构模型的演变经历了: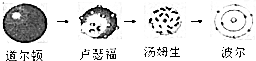 |
5.乙醛能与银氨溶液反应析出银,如果条件控制适当,析出的银会均匀分布在试管上,形成光亮的银镜,这个反应叫银镜反应.银镜的光亮程度与反应条件有关,某课外活动小组同学在课外活动中对乙醛的银镜反应进行了探究.
Ⅰ.探究银镜反应的最佳实验条件的部分实验数据如下表:
请回答下列问题:
(1)若只进行实验1和实验3,其探究目的是比较乙醛用量不同,生成银镜的时间(速度或质量均可).
(2)推理当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11时,出现银镜的时间范围是在6.5~9min之间.
(3)进一步实验还可探索银氨溶液的用量不同或pH不同对出现银镜快慢的影响.
Ⅱ.探究对废液的回收处理:银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环
境,且造成银资源的浪费.通过查找资料,已知从银氨溶液中提取银的一种实验流程如下:
$→_{①}^{(NH_{4})_{2}S}$$→_{②}^{过滤、洗涤}$$→_{③}^{烘干}$Ag2S$→_{④}^{铁粉还原}$银粉
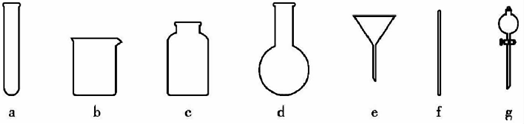
(4)操作④的方法是把Ag2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag2S变成银粉,反应的化学方程式为Ag2S+Fe+2HCl$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+FeCl2+H2S↑.过滤需要用到的玻璃仪器有bef(填编号).要得到纯净的Ag2S沉淀,需要洗涤沉淀,实验室过滤器中洗涤沉淀的操作是:沿着玻璃棒向过滤器注入蒸馏水浸没沉淀,水自然流下,重复2~3次.
(5)根据电化原理也可Ag2S转变为Ag,方法是:在铝质容器中加入食盐溶液,再将表面生成Ag2S的银器浸入该溶液中,一段时间后发现黑色会褪去.
①该装置中银器为正极.
②该装置总反应的化学方程式为2Al+3Ag2 S+3H2O=2Al(OH)3+6Ag+3H2S↑.
Ⅰ.探究银镜反应的最佳实验条件的部分实验数据如下表:
| 实验序号 | 银氨溶液 | 乙醛的量/滴 | 水浴温度/℃ | 反应混合液的pH | 出现银镜时间 |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 4 | 1 | 3 | 30 | 11 | 9 |
| 5 | 1 | 3 | 50 | 11 | 6 |
| 6 | 1 | 5 | 80 | 11 | 3 |
(1)若只进行实验1和实验3,其探究目的是比较乙醛用量不同,生成银镜的时间(速度或质量均可).
(2)推理当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11时,出现银镜的时间范围是在6.5~9min之间.
(3)进一步实验还可探索银氨溶液的用量不同或pH不同对出现银镜快慢的影响.
Ⅱ.探究对废液的回收处理:银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环
境,且造成银资源的浪费.通过查找资料,已知从银氨溶液中提取银的一种实验流程如下:
$→_{①}^{(NH_{4})_{2}S}$$→_{②}^{过滤、洗涤}$$→_{③}^{烘干}$Ag2S$→_{④}^{铁粉还原}$银粉
(4)操作④的方法是把Ag2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag2S变成银粉,反应的化学方程式为Ag2S+Fe+2HCl$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+FeCl2+H2S↑.过滤需要用到的玻璃仪器有bef(填编号).要得到纯净的Ag2S沉淀,需要洗涤沉淀,实验室过滤器中洗涤沉淀的操作是:沿着玻璃棒向过滤器注入蒸馏水浸没沉淀,水自然流下,重复2~3次.

(5)根据电化原理也可Ag2S转变为Ag,方法是:在铝质容器中加入食盐溶液,再将表面生成Ag2S的银器浸入该溶液中,一段时间后发现黑色会褪去.
①该装置中银器为正极.
②该装置总反应的化学方程式为2Al+3Ag2 S+3H2O=2Al(OH)3+6Ag+3H2S↑.
6.浓度均为0.1mol/L、体积为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )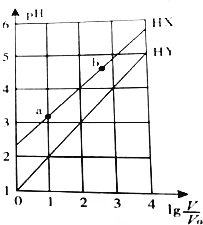

| A. | HX、HY都是弱酸,且HX的酸性比HY的弱 | |
| B. | 常温下,由水电离出的c(H+)•c(OH-):a<b | |
| C. | 相同温度下,电离常数K( HX):a>b | |
| D. | lg$\frac{V}{{V}_{0}}$=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则$\frac{c({X}^{-})}{c({Y}^{-})}$减小 |