题目内容
5.氯胺(NH2Cl)在中性或酸性溶液中是一种有效的强力消毒剂,据此判断,氯胺在水溶液中因水解产生的物质是( )| A. | HClO和HCl | B. | NH4Cl和HCl | C. | NH4Cl和HClO | D. | NH4Cl和HClO3 |
分析 NH2Cl中N为-3价,Cl为+1价,水解可生成HClO和NH3,其中HClO具有强氧化性,可用于杀菌消毒,以此解答.
解答 解:NH2Cl中N为-3价,Cl为+1价,在水中水解生成一种有强氧化性的物质,说明生成HClO,同时应生成NH3,酸性环境下,就应生成铵盐,只有C符合,
故选C.
点评 本题考查含氯化合物的性质以及应用,侧重于水解反应的考查,为高频考点,题目贴近高考,注重于学生的分析能力和自学能力的考查,有利于培养学生的良好的科学素养,题目难度不大.

练习册系列答案
相关题目
12.下列关于碳氢化合物的说法正确的是( )
| A. | 碳氢化合物的通式为CnH2n+2 | |
| B. | 燃烧产物为CO2和H2O的化合物一定是碳氢化合物 | |
| C. | 碳原子间以单键相连的烃是烷烃 | |
| D. | 烷烃分子的相对分子质量一定是偶数 |
13.下列实验现象预测错误的是( )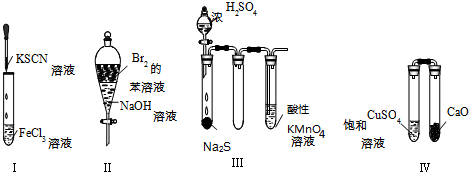

| A. | 实验Ⅰ:试管中溶液颜色变为红色 | |
| B. | 实验Ⅱ:振荡后静置,上层溶液颜色保持不变 | |
| C. | 实验Ⅲ:酸性KMnO4溶液中出现气泡,但颜色不会褪去 | |
| D. | 实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
10.今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-,现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.792L(已换算成标准状况,且设气体全部逸出);②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.根据上述实验,以下推测正确的是( )
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32- 可能存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
17.现有部分短周期元素的性质或原子结构如表:
(1)C在周期表中的位置第二周期VA族;C的氢化物水溶液呈碱性(填“酸”、“碱”或“中”),其原因NH3.H2O?NH4++OH-(用离子方程式表达).
(2)E原子的电子式为 ;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).
;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).
A.对比气态氢化物水溶液的酸性强弱,酸性越强,则元素的非金属性越强
B.对比最高价氧化物的水化物的酸性强弱,酸性越强,则元素的非金属性越强
C.对比简单阴离子的还原性强弱,阴离子还原性越强,则元素的非金属性越强
(3)B与氧元素形成1:1化合物的电子式为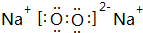 ,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
| 元素编号 | 元素性质或原子结构 |
| B | 短周期主族元素中原子半径最大 |
| C | 单质为双原子分子,是空气的主要成分,化学性质稳定 |
| D | 元素最高正价是+7价 |
| E | M层上有6个电子 |
(2)E原子的电子式为
 ;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).
;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).A.对比气态氢化物水溶液的酸性强弱,酸性越强,则元素的非金属性越强
B.对比最高价氧化物的水化物的酸性强弱,酸性越强,则元素的非金属性越强
C.对比简单阴离子的还原性强弱,阴离子还原性越强,则元素的非金属性越强
(3)B与氧元素形成1:1化合物的电子式为
 ,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
14.配制一定物质的量浓度的溶液所使用的容量瓶上没有标明的是( )
| A. | 规格 | B. | 温度 | C. | 刻度线 | D. | 物质的量浓度 |
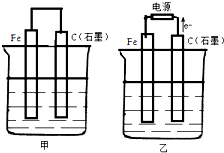 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.
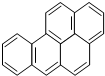 ,它是一种稠环芳香烃,其化学式为C20H12,此物质中碳元素和氢元素的质量比为20:1.
,它是一种稠环芳香烃,其化学式为C20H12,此物质中碳元素和氢元素的质量比为20:1.