题目内容
20.SO2及Cl2是实验室常见的两种气体.(1)实验室制备、收集干燥的SO2,所需仪器如下.装置A产生SO2,按气流方向连接各仪器接口,顺序为a→d→e→c→b→f,装置D的作用是安全瓶,防止倒吸.
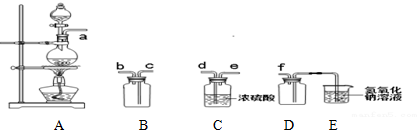
(2)实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要饱和食盐水、氢氧化钠溶液(填写试剂或
溶液名称).
(3)将Cl2通入水中,所得溶液中具有氧化性的含氯粒子有Cl2、HClO、ClO-(填微粒符号)
(4)某小组利用刚吸收过少量SO2的NaOH溶液对Cl2进行尾气处理.
①请完成吸收初期的化学方程式:Cl2+Na2SO3+2NaOH=2NaCl+Na2SO4+H2O
②吸收一段时间后,某同学取出2mL吸收后的溶液(强碱性)于试管中,充分振荡后向其中滴加3~4滴淀粉-KI溶液,发现溶液先变蓝,随即又褪去.溶液先变蓝,说明吸收后的溶液中存在ClO-(填微粒符号),用离子方程式表示蓝色褪去的可能原因:I2+2OH-═I-+IO-+H2O.
分析 (1)利用实验仪器的连接,实验室制备、收集干燥的SO2,装置A产生SO2,装置B为收集气体的集气瓶,装置C为干燥二氧化硫,装置D为安全瓶,装置E为吸收过量二氧化硫气体尾气吸收;
(2)实验室制取纯净的氯气,利用二氧化锰和浓盐酸加热反应生成氯气中含氯化氢和水蒸气,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,剩余氯气不能排放需要氢氧化钠溶液吸收;
(3)氯气和水反应生成盐酸和次氯酸,反应为化学平衡,具有氧化性的有氯气、次氯酸、次氯酸根离子;
(4)①氯气具有氧化性能氧化亚硫酸钠生成硫酸钠;
②取出2mL吸收后的溶液(强碱性)于试管中,充分振荡后向其中滴加3~4滴淀粉-KI溶液,发现溶液先变蓝,随即又褪去.溶液先变蓝说明溶液中含氧化性离子能氧化碘离子生成碘单质,过量的强碱溶液中是次氯酸根离子具有氧化性,随后蓝色消失是碘单质溶解于过量的强碱溶液中.
解答 解:(1)收集二氧化硫应先干燥再收集.二氧化硫的密度比空气大,要从c口进气,最后进行尾气处理.因为二氧化硫易于氢氧化钠反应,故D的作用是安全瓶,防止倒吸,
故答案为:d;e;c;b;安全瓶,防止倒吸;
(2)实验室制取纯净的氯气,利用二氧化锰和浓盐酸加热反应生成氯气中含氯化氢和水蒸气,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,剩余氯气不能排放需要氢氧化钠溶液吸收,除了二氧化锰、浓盐酸和浓硫酸,还需要饱和食盐水、氢氧化钠溶液,
故答案为:饱和食盐水;氢氧化钠溶液;
(3)将Cl2通入水中,氯气和水反应生成盐酸和次氯酸,反应为化学平衡,所得溶液中具有氧化性的含氯粒子为:Cl2、HClO、ClO-,
故答案为:Cl2、HClO、ClO-;
(4)①氯气具有氧化性能氧化亚硫酸钠生成硫酸钠,反应的化学方程式为:Cl2+Na2SO3+2NaOH=2NaCl+Na2SO4+H2O,
故答案为:2NaCl+Na2SO4+H2O;
②吸收一段时间后,取出2mL吸收 后的溶液(强碱性)于试管中,充分振荡后向其中滴加3~4滴淀粉-KI溶液,发现溶液先变蓝,随即又褪去.溶液先变蓝说明溶液中含氧化性离子能氧化碘离子生成碘单质,过量的强碱溶液中是次氯酸根离子具有氧化性,随后蓝色消失是碘单质溶解于过量的强碱溶液中,反应的离子方程式为:I2+2OH-═I-+IO-+H2O,
故答案为:ClO-;I2+2OH-═I-+IO-+H2O.
点评 本题考查了物质性质验证的实验方法、反应现象、离子方程式书写等知识点,掌握基础是解题关键,题目难度中等.

 某纯净气体的质量与分子个数(N)的关系如图所示(设NA为阿伏加德罗常数的值),则该气体可能为( )
某纯净气体的质量与分子个数(N)的关系如图所示(设NA为阿伏加德罗常数的值),则该气体可能为( )| A. | CO | B. | CO2 | C. | CH4 | D. | SO2 |
| A. | 2g | B. | 4g | C. | 8g | D. | 18g |
| A. | HClO和HCl | B. | NH4Cl和HCl | C. | NH4Cl和HClO | D. | NH4Cl和HClO3 |
| A. | 高级脂肪酸甘油酯相对分子质量很大,属于高分子化合物 | |
| B. | 缩聚反应的单体至少有两种物质 | |
| C. | 线性高分子的长链上可以带支链 | |
| D. | 电木具有热塑性 |
| A. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3•H2O)>K(HCN) | |
| B. | 由水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.向含有Cl-、CrO42-且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-) |
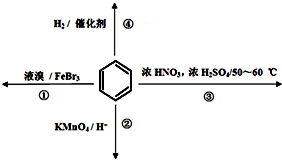
| A. | 反应①常温下不能进行 | |
| B. | 反应②不发生,但是仍有分层现象,紫色层在下层 | |
| C. | 反应③为加成反应 | |
| D. | 反应④能发生,从而证明苯中是单双键交替结构 |
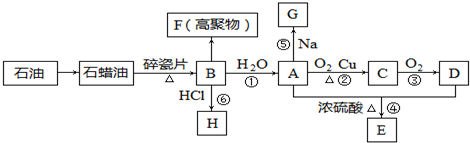
 .
. .
.