题目内容
17.现有部分短周期元素的性质或原子结构如表:| 元素编号 | 元素性质或原子结构 |
| B | 短周期主族元素中原子半径最大 |
| C | 单质为双原子分子,是空气的主要成分,化学性质稳定 |
| D | 元素最高正价是+7价 |
| E | M层上有6个电子 |
(2)E原子的电子式为
 ;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).
;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).A.对比气态氢化物水溶液的酸性强弱,酸性越强,则元素的非金属性越强
B.对比最高价氧化物的水化物的酸性强弱,酸性越强,则元素的非金属性越强
C.对比简单阴离子的还原性强弱,阴离子还原性越强,则元素的非金属性越强
(3)B与氧元素形成1:1化合物的电子式为
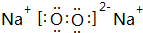 ,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
分析 各元素均为短周期元素,其中B是短周期主族元素中原子半径最大的,则B为Na;C的单质为双原子分子,是空气的主要成分,化学性质稳定,则C为N元素;元素D的最高正价是+7价,则D为Cl;E元素原子的M层上有6个电子,可推知E为S元素.
解答 解:各元素均为短周期元素,其中B是短周期主族元素中原子半径最大的,则B为Na;C的单质为双原子分子,是空气的主要成分,化学性质稳定,则C为N元素;元素D的最高正价是+7价,则D为Cl;E元素原子的M层上有6个电子,可推知E为S元素.
(1)C为N元素,在周期表中的位置:第二周期VA族;C的氢化物为NH3,其水溶液中一水合氨电离:NH3.H2O?NH4++OH-,溶液呈碱性,
故答案为:第二周期VA族;碱;NH3.H2O?NH4++OH-;
(2)E为S元素,原子的电子式为 ,
,
同周期自左而右元素非金属性增强,故Cl元素非金属性比S的强,
A.气态氢化物水溶液的酸性强弱不能比较元素非金属性强弱,如HF为弱酸,而HCl为强酸,故A错误;
B.最高价氧化物的水化物的酸性强弱与中心元素的非金属性强弱一致,故B正确;
C.阴离子还原性越强,则元素的非金属性越弱,故C错误,
故答案为: ;Cl;B;
;Cl;B;
(3)B为钠元素,与氧元素形成1:1化合物为Na2O2,电子式为 ,含有离子键、非极性键,该化合物加入FeCl2溶液中,先发生反应:2Na2O2+2H2O═4NaOH+O2↑,由于无气体产生,说明氧气完全反应,假设过氧化钠为2mol,生成氧气为1mol,NaOH为4mol,1mol氧气可以氧化4molFe2+得到4molFe3+离子,同时氧气转化可以得到4molOH-,总共有OH-为(4+4)mol=8mol,可以得到Fe(OH)3为$\frac{8}{3}$mol,故还生成FeCl3为$\frac{4}{3}$mol,由钠离子守恒得到4molNaCl,则反应离子方程式为:3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+,
,含有离子键、非极性键,该化合物加入FeCl2溶液中,先发生反应:2Na2O2+2H2O═4NaOH+O2↑,由于无气体产生,说明氧气完全反应,假设过氧化钠为2mol,生成氧气为1mol,NaOH为4mol,1mol氧气可以氧化4molFe2+得到4molFe3+离子,同时氧气转化可以得到4molOH-,总共有OH-为(4+4)mol=8mol,可以得到Fe(OH)3为$\frac{8}{3}$mol,故还生成FeCl3为$\frac{4}{3}$mol,由钠离子守恒得到4molNaCl,则反应离子方程式为:3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+,
故答案为: ;离子、非极性;3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
;离子、非极性;3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
点评 本题以元素推断为载体,考查电子式、元素周期律、离子方程式书写等,(3)中离子方程式书写为易错点、难点,是对学生综合能力的考查.

 名校课堂系列答案
名校课堂系列答案| A. | HClO和HCl | B. | NH4Cl和HCl | C. | NH4Cl和HClO | D. | NH4Cl和HClO3 |
| A. | 高级脂肪酸甘油酯相对分子质量很大,属于高分子化合物 | |
| B. | 缩聚反应的单体至少有两种物质 | |
| C. | 线性高分子的长链上可以带支链 | |
| D. | 电木具有热塑性 |
| A. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3•H2O)>K(HCN) | |
| B. | 由水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.向含有Cl-、CrO42-且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-) |
| A. | 0.01mol | B. | 1g | C. | 4 | D. | 0.02mol |
| A. | 若两烧杯中铝粉均已完全溶解,则两烧杯中放出氢气的量相同 | |
| B. | 若两烧杯中铝粉均未完全溶解,则盛氢氧化钠溶液的烧杯中放出氢气的量更多 | |
| C. | 若反应后,有一个烧杯中铝粉完全溶解,另一个烧杯中铝粉没有完全溶解,则那个还有铝没有溶解的烧杯原来盛着的是氢氧化钠溶液 | |
| D. | 无论如何,盐酸与铝粉反应产生的H2不可能比氢氧化钠溶液与铝粉反应产生的H2多 |
 .
. .
.