��Ŀ����
12����������Ҫ�ɷ���FeCO3����������ԭ�ϣ���֪FeCO3Ϊ��ɫ���壬������ˮ���ڸ���������ȶ�����ʪ��������ϳ�ʱ�䱻����ΪFe��OH��3��I����1����ͬѧȡһ����̼�������������ձ��У���������ˮ�����ձ���������ƽ�����ϣ������̷�����������ƽƽ�⣮���ýϳ�ʱ�������ˮ�����������۲쵽��ƽ��ָ���ƫ�ң��ƫ����ƫ�ҡ�����������ƫת���������ù����л��ɹ۲쵽��ʵ������Ϊ��ɫ�����ɺ��ɫ���壨��������ݣ���
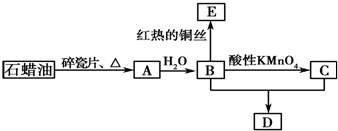
II����ͬѧ���ͼ1��ʾ��װ���Ʊ�FeCO3����FeSO4��NaHCO3��Һ���þ���к���ȴ������ˮ���ƣ�����FeSO4��Һ�м����������ۣ����μ�NaHCO3��Һ��۲쵽�Թ��г��ְ�ɫ������ͬʱ�д�����ɫ�������ɣ�
��2��������������CO2 �������ʽ����
��3����ͬѧ��ɫ�����ijɷ�������飬���������¼��裬�벹����ɼ���3��
����1����ɫ������FeCO3��
����2����ɫ������Fe��OH��2��
����3����ɫ������Fe��OH��2��FeCO3��
��4��������1������д���йط�Ӧ�Ļ�ѧ����ʽ��FeSO4+2NaHCO3=FeCO3��+H2O+CO2��+Na2SO4��
��5��������2������˵���þ���к���ȴ������ˮ����FeSO4��NaHCO3��Һ��Ŀ���dz�ȥˮ���ܽ����������ֹ���ɵ�Fe��OH��2��Ѹ��������
�����һ��ʵ�鷽����֤����2������д��ʵ�鲽�衢Ԥ������ͽ��ۣ�ʵ������������ҩƷ��ѡ��
�������ɫ�������Թ���ͨ�����������ɫ����Ѹ�ٱ�ɻ���ɫ������Ϊ���ɫ����˵������2������
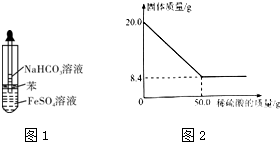
III����ȡ20.0g�����������м�������ϡ���ᣬ��ַ�Ӧ����ù�������������ϡ�����������ϵ��ͼ2��ʾ�������������������ʲ��μӷ�Ӧ����������ˮ����
��6����������FeCO3����������Ϊ50%
��7������ϡ����ij�1mol L-1HNO3����÷�Ӧ�����ӷ���ʽΪ3FeCO3+10H++NO3?=3Fe3++3CO2��+NO��+5H2O������Ӧ�ݳ���������һ������O2���ѭ��ͨ�뷴ӦҺ�У�Ŀ���Ǽ��ٻ�����Ⱦ��NO��H2O��O2��Ӧ���ֵõ����ᣬ���ԭ�������ʣ�
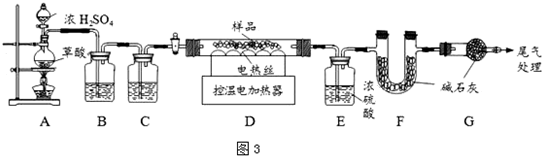
IV��ij����ɷ�ΪFe2O3•xH2O��FeCO3��Ϊȷ������ɣ���ȤС���ȡ��������Ʒ25.4g���ڿ�����Ա��ָ������ͼ3װ�ý���ʵ�飮
���������ϡ�
��Fe2O3•xH2Oʧȥ�ᾧˮ�¶�Ϊ110�棬FeCO3��282��ֽ�ΪFeO��CO2��
���¶ȸ���500��ʱ������������ܱ�CO��ԭ��
��8��װ���ʵ��װ�ú�����Ҫ���װ�������ԣ�
��9��װ��A�еķ�ӦΪ��H2C2O4 �����ᣩ$\frac{\underline{\;Ũ����\;}}{��}$ CO��+CO2��+H2O��ͨ��B��Cװ�ÿɵõ����������CO���壬ϴ��ƿB��Ӧʢ��c��ѡ����ţ���
a��Ũ���� b�������ʯ��ˮ c������������Һ
��10���ֿ���Dװ���е��¶�Ϊ300�����������ȷֽ⣬ֱ��Dװ����ʣ������������ٱ仯Ϊֹ����ȴ��װ��E����3.6g��װ��F����2.2g��
����Ʒ��FeCO3������m��FeCO3��=5.8g��x=2��
��11����ȱ��Gװ�ã���õ�m��FeCO3��ƫ��ѡ�ƫ����ƫС���������䡱����ͬ����x��ֵ��ƫ��
���� I��1������ˮ������£����ýϳ�ʱ���̼�������ᷢ����Ӧ��4FeCO3+6H2O+O2=4Fe��OH��3+4CO2�����ݷ���ʽ���������α仯��
FeCO3�ǰ�ɫ���塢Fe��OH��3���ɫ���壻
II����2��HCO3-��Fe 2+��ٽ�ˮ������Fe��OH��2��CO2��
��3��������Ͽ���֪����3ΪFe��OH��2��FeCO3�Ļ���
��4�������ɫ������̼��������������������̼�����Ʒ������ֽⷴӦ��Ϊ��������ԭ��Ӧ������Ԫ���غ㼰������ȶ�����֪��Ӧ����ʽ��
��5���������������������˵����к���Һ�в���������
����Fe��OH��2��֤��ͨ��ѧ����Ϥ����ɫ�仯����ƣ�����Һ��ͨ������������������ɫ�Ƿ�仯�жϣ�
��6��̼��������ϡ���ᷴӦ�������������Ͷ�����̼��ˮ��ʣ�����Ϊδ��Ӧ�����ʣ���μӷ�Ӧ��m��FeCO3��=��20.0-8.4��g=11.6g��̼����������������=$\frac{̼����������}{��Ʒ����}��100%$��
��7��̼�����������ᷢ��������ԭ��Ӧ�����IJ���Ϊ+3�ۣ�ϡ���ỹԭ����ΪNO��NO��������Ӧ���ɶ�������������������ˮ��Ӧ�������
��8��ʵ�����������װ���ʵ��װ�ú�����Ҫ���װ�������ԣ�
��9��������̼�����������Ҫ��ȥCO2Ӧ��ѡȡ�ܽ��Դ�ļ�����Һ��
��10���¶�Ϊ300��ʱ��Fe2O3•xH2Oʧȥ�ᾧˮ���ֽ��¶�Ϊ110�棩��FeCO3�ֽ�ΪFeO��CO2���ֽ��¶�Ϊ282�棩��װ��E����3.6gΪˮ��n��H2O��=$\frac{3.6g}{18}$=0.2mol������ˮ�����غ��n��Fe2O3•xH2O��=$\frac{0.2}{x}$mol��װ��F����2.2gΪ������̼��n��CO2��=$\frac{2.2g}{44g/mol}$=0.05mol������Cԭ���غ��n��FeCO3��=0.05mol��
0.05mol FeCO3������0.05mol��116mol L-1=5.8g
��Fe2O3•xH2O����Ϊ��25.4g-5.8g=19.6g��
$\frac{0.2}{x}$ mol����160+18x��mol L-1=19.6g
�ݴ˼���xֵ��
��11����ȱ��Gװ�ã�F�����ղ��ֿ����е�ˮ�������̼�����أ�
��� �⣺��1������ˮ������£����ýϳ�ʱ���̼�������ᷢ����Ӧ��4FeCO3+6H2O+O2=4Fe��OH��3+4CO2���Ӷ�ʹ����������������ָ���ƫ�ң�̼�������ǰ�ɫ���塢���������Ǻ��ɫ���壬������ɫҲ��FeCO3��ɫ��ΪFe��OH��3���ɫ��
�ʴ�Ϊ��ƫ�ң���ɫ�����ɺ��ɫ���壨��������ݣ���
��2��HCO3-��Fe 2+��ٽ�ˮ������Fe��OH��2��CO2����Һ�в���������ΪCO2��
�ʴ�Ϊ��CO2��
��3��������Ͽ���֪����3ΪFe��OH��2��FeCO3��
�ʴ�Ϊ��Fe��OH��2��FeCO3��
��4�������ɫ������̼��������������������̼�����Ʒ������ֽⷴӦ��Ϊ��������ԭ��Ӧ������Ԫ���غ㼰������ȶ�����֪��Ӧ����ʽΪ��FeSO4+2NaHCO3=FeCO3��+H2O+CO2��+Na2SO4��
�ʴ�Ϊ��FeSO4+2NaHCO3=FeCO3��+H2O+CO2��+Na2SO4��
��5����к���ȴ������ˮ����FeSO4��NaHCO3��Һ���Գ�ȥˮ���ܽ����������ֹ���ɵ�Fe��OH��2��Ѹ��������������Fe��OH��2��֤��ͨ��ѧ����Ϥ����ɫ�仯����ƣ�����鷽��Ϊ�������ɫ�������Թ���ͨ�����������ɫ����Ѹ�ٱ�ɻ���ɫ������Ϊ���ɫ����˵������2������
�ʴ�Ϊ����ȥˮ���ܽ����������ֹ���ɵ�Fe��OH��2��Ѹ��������
�������ɫ�������Թ���ͨ�����������ɫ����Ѹ�ٱ�ɻ���ɫ������Ϊ���ɫ����˵������2������
��6��̼��������ϡ���ᷴӦ�������������Ͷ�����̼��ˮ��ʣ�����Ϊδ��Ӧ�����ʣ���μӷ�Ӧ��m��FeCO3��=��20.0-8.4��g=11.6g��̼����������������=$\frac{̼����������}{��Ʒ����}��100%$=$\frac{11.6g}{20.0g}$��100%=58%��
�ʴ�Ϊ��58%��
��7��̼�����������ᷢ��������ԭ��Ӧ�����IJ���Ϊ+3�ۣ�ϡ���ỹԭ����ΪNO����Ӧ����ʽΪ3FeCO3+10H++NO3?=3Fe3++3CO2��+NO��+5H2O��NO��������Ӧ���ɶ�������������������ˮ��Ӧ�������ᣬΪ��ֹNO��Ⱦ��������Ϊ���ԭ�������ʣ���ѭ��ʹ��NO��
�ʴ�Ϊ��3FeCO3+10H++NO3?=3Fe3++3CO2��+NO��+5H2O�����ٻ�����Ⱦ��NO��H2O��O2��Ӧ���ֵõ����ᣬ���ԭ�������ʣ�
��8��ʵ�����������װ���ʵ��װ�ú�����Ҫ���װ�������ԣ�
�ʴ�Ϊ�����װ�������ԣ�
��9��������̼�����������Ҫ��ȥCO2Ӧ��ѡȡ�ܽ��Դ�ļ�����Һ��Ҫ��ȥCO2���ѡ������������Һ�������ʯ��ˮŨ�ȵͣ���������
�ʴ�Ϊ��c��
��10���¶�Ϊ300��ʱ��Fe2O3•xH2Oʧȥ�ᾧˮ���ֽ��¶�Ϊ110�棩��FeCO3�ֽ�ΪFeO��CO2���ֽ��¶�Ϊ282�棩��װ��E����3.6gΪˮ��n��H2O��=$\frac{3.6g}{18}$=0.2mol������ˮ�����غ��n��Fe2O3•xH2O��=$\frac{0.2}{x}$mol��װ��F����2.2gΪ������̼��n��CO2��=$\frac{2.2g}{44g/mol}$=0.05mol������Cԭ���غ��n��FeCO3��=0.05mol��
0.05mol FeCO3������0.05mol��116mol L-1=5.8g
��Fe2O3•xH2O����Ϊ��25.4g-5.8g=19.6g��
$\frac{0.2}{x}$ mol����160+18x��mol L-1=19.6g
x=2��
�ʴ�Ϊ��5.8��2��
��11����ȱ��Gװ�ã�F�����ղ��ֿ����е�ˮ�������̼�����أ�ʹ��õ�m��FeCO3��ƫ��������Fe2O3•xH2O����ƫС�����������xƫ��
�ʴ�Ϊ��ƫ��ƫ��
���� ���⿼�������Ʊ������ʺ����ⶨ��Ϊ��Ƶ���㣬���ؿ���ѧ���ۺϷ����жϼ�������������ȷ�������ʡ������������Ĺ�ϵ��ʵ����������������ǽⱾ��ؼ���ע��ͼ3��Gװ�õ����ã��ܶ�ͬѧ����©��������ˮ�����Ͷ�����̼�����´���Ϊ�״��㣮

| �� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 2 | C | N | O | F | Ne | |||
| 3 | Na | Al | P | S | Cl |
��2������ԭ�ӽṹʾ��ͼ��
 ��
����3���γɻ�������������Ԫ����C��
��4��HF��H2O�У����ȶ��Խ�ǿ����HF��
��5��N��P�У�ԭ�Ӱ뾶��С����N��
��6�������£�����Ũ�����з����ۻ��Ľ�����Al��
��7��Ԫ������������Ӧˮ�����У�������ǿ����NaOH���ѧʽ����������ǿ����HClO4���H2SO4����HClO4������
��Һ̬HF�д����������������ӱ�HCl���ȶ�
�ڽ�SO2ͨ����ɫʯ����Һ����Һ�ȱ�����ɫ
�ۿ���Ũ��ˮ�������������Ĺܵ��Ƿ���й©
����Fe��NO3��2��Һ��ͨ������⻯�����壬����Fe2+������ΪFe3+
�ݽ������Ķ�����̼����ͨ���������Һ�У�Ȼ��������ɣ����ڸ����³���������õ��Ĺ���Ϊ̼���ƺͶ������裮
| A�� | �٢ڢ� | B�� | �ڢۢ� | C�� | �٢ڢܢ� | D�� | �٢ۢܢ� |
| A�� | 13.8g | B�� | 69g | C�� | 34.5g | D�� | 138g |
| A�� | NaCl��HCl����ˮ����������� | B�� | SiO2�ͱ�����ۻ� | ||
| C�� | ��������ۻ��;��������� | D�� | �ƾ��ͱ���������ˮ |
| A�� | ��ϡHNO3�ܽ�FeS���壺FeS+2H+�TFe2++H2S�� | |
| B�� | ��Na2O2����Ͷ��H218O�У�2Na2O2+H218O�TNa++4OH-+8O2�� | |
| C�� | ��NH4Al��SO4��2��Һ�е���Ba��OH��2��Һ��ǡ��ʹSO42-��ȫ������NH4++Al3++2SO42-+2Ba2++4OH-�TAl��OH��3��+NH3•H2O+BaSO4�� | |
| D�� | ��ʯī�����缫���MgCl2��Һ��2C1-+2H2O$\frac{\underline{\;���\;}}{\;}$C12��+2OH-+H2�� |
| A�� | �������������ƿ���ܽⲢϡ�����̶��ߣ����Ƴ�һ�����ʵ���Ũ�ȵ���Һ | |
| B�� | ��ʢ��NaOH���ձ��м�����ˮʹ���ܽ⣬������ת������ƿ�� | |
| C�� | ��������ƽ��ȡ10.60 g��Na2CO3���壬����1 L��ˮ�����0.1 mol/L����Һ | |
| D�� | �������ƿ�Ƿ�©ˮ�ķ����ǣ�������ƿ�м�ˮ������ƿ����������ƿ������������©ˮ����ƿ����ת180�㣬�ٵ����������Ƿ�©ˮ |