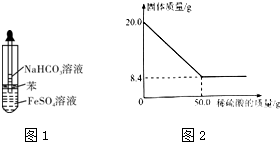
题目内容
3.下列叙述中不正确的是( )①液态HF中存在氢键,所以其分子比HCl更稳定
②将SO2通入紫色石蕊溶液,溶液先变红后褪色
③可用浓氨水检验输送氯气的管道是否有泄漏
④在Fe(NO3)2溶液中通入过量碘化氢气体,最终Fe2+被氧化为Fe3+
⑤将过量的二氧化碳气体通入硅酸钠溶液中,然后加热蒸干,再在高温下充分灼烧最后得到的固体为碳酸钠和二氧化硅.
| A. | ①②⑤ | B. | ②③④ | C. | ①②④⑤ | D. | ①③④⑤ |
分析 ①分子的稳定性与氢键无关;
②SO2不能漂白紫色石蕊溶液;
③浓氨水与氯气反应生成氯化铵,会产生大量白烟;
④酸性条件下,硝酸根离子与碘离子先反应生成单质碘;
⑤过量的二氧化碳气体通入硅酸钠溶液,生成碳酸氢钠和硅酸,加热碳酸氢钠、硅酸均分解,最后又生成硅酸钠.
解答 解:①氢化物的稳定性与非金属的非金属性强弱有关,与氢键无关,氢键影响氢化物的熔沸点,故错误;
②SO2通入紫色石蕊溶液,溶液变红,因为是酸性氧化物,SO2不能漂白紫色石蕊溶液,所以溶液不褪色,故错误;
③浓氨水与氯气反应生成氯化铵,会产生大量白烟,所以可用浓氨水检验输送氯气的管道是否有泄漏,故正确;
④酸性条件下,硝酸根离子与碘离子先反应生成单质碘,在Fe(NO3)2溶液中通入过量碘化氢气体,最终碘离子被氧化为单质碘,故错误;
⑤过量的二氧化碳气体通入硅酸钠溶液,生成碳酸氢钠和硅酸,加热碳酸氢钠、硅酸均分解,则在高温下充分灼烧,碳酸钠和二氧化硅反应又生成硅酸钠,故错误.
故选C.
点评 本题考查较综合,涉及化学键、物质的性质等,注重高频考点的考查,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| B. | 将NH4Cl溶液蒸干制备NH4Cl固体 | |
| C. | 因为NH3能使酚酞溶液变红,NH3用于设计喷泉实验 | |
| D. | 浓氨水可检验氯气管道是否漏气 |
18.下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在这些元素中,金属性最强的元素是K,最活泼的非金属元素是F;
(2)化学性质最不活泼的元素是Ar,其原子的原子结构示意图为 ;
;
(3)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(4)在③~⑦元素中,原子半径最大的是Na;
(5)在 ⑦与 ⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)化学性质最不活泼的元素是Ar,其原子的原子结构示意图为
 ;
;(3)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(4)在③~⑦元素中,原子半径最大的是Na;
(5)在 ⑦与 ⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
8.某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质.某化学课外小组设计如图流程,取该矿样为原料生产CuC12•2H2O 晶体.
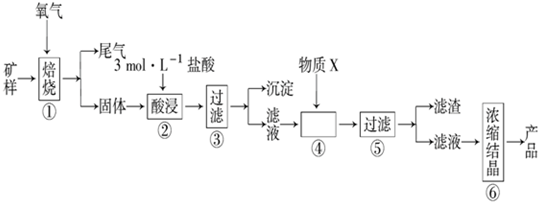
已知:常温下,金属离子开始沉淀和沉淀完全时的pH 如表.
回答下列问题:
(l)步骤①的焙烧过程中需要通入氧气.在实验室中,可使用常见化学物质利用如图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2 ↑、2Na2O2+2H2O=4NaOH+O2↑.
(2)焙烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:2(NH4)2SO3+O2═2(NH4)2SO4、2NH4HSO3+O2═2NH4HSO4.
(3)步骤②酸浸过程中,需要用到3mol•L-1的盐酸100mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有100ml的容量瓶,量筒.
(4)步骤④加入物质X的目的是控制溶液的pH,使Fe3+以沉淀的形式全部沉淀,物质X 可以选用下列物质中的D.
(A)氢氧化钠 (B)稀盐酸 (C)氨水 (D)氧化铜
(5)当溶液中金属离子浓度低于1×10-5 mol•L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]=1×10-15.

已知:常温下,金属离子开始沉淀和沉淀完全时的pH 如表.
| 金属 离子 | 氢氧化物开始沉淀的pH | 氢氧化物沉淀完全的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(l)步骤①的焙烧过程中需要通入氧气.在实验室中,可使用常见化学物质利用如图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2 ↑、2Na2O2+2H2O=4NaOH+O2↑.
(2)焙烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:2(NH4)2SO3+O2═2(NH4)2SO4、2NH4HSO3+O2═2NH4HSO4.
(3)步骤②酸浸过程中,需要用到3mol•L-1的盐酸100mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有100ml的容量瓶,量筒.
(4)步骤④加入物质X的目的是控制溶液的pH,使Fe3+以沉淀的形式全部沉淀,物质X 可以选用下列物质中的D.
(A)氢氧化钠 (B)稀盐酸 (C)氨水 (D)氧化铜
(5)当溶液中金属离子浓度低于1×10-5 mol•L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]=1×10-15.
15.区别固体Na2CO3和NaHCO3最好的方法是( )
| A. | 加澄清的石灰水 | B. | 两者分别与同浓度的稀盐酸反应 | ||
| C. | 溶于水,比较其溶解性 | D. | 两者分别加入NaOH溶液 |
13.四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.
(1)写出元素T的离子结构示意图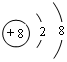 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;写出Z元素原子的原子结构示意图:
;写出Z元素原子的原子结构示意图: ;元素Y的最高价氧化物对应水化物的电子式
;元素Y的最高价氧化物对应水化物的电子式
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)元素T与氟元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是bc
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂. | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 | 单质质软、银白色固体、导电性强.单质在空气中燃烧发出黄色的火焰. | 第三周期元素的简单离子中半径最小 |
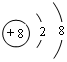 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;写出Z元素原子的原子结构示意图:
;写出Z元素原子的原子结构示意图: ;元素Y的最高价氧化物对应水化物的电子式
;元素Y的最高价氧化物对应水化物的电子式
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)元素T与氟元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是bc
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
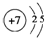 .
.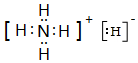 .
.