题目内容
12.已知氨可以与灼热的氧化铜反应得到氮气和金属铜,反应方程式为2NH3+3CuO $\frac{\underline{\;\;△\;\;}}{\;}$ N2+3H2O+3Cu,用示意图中的装置可以实现该反应.回答下列问题: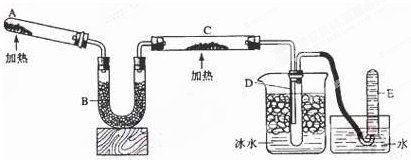
(1)A中发生反应的化学方程式是2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.检验氨气通常采用的方法及现象是用湿润的红色石蕊试纸检验,试纸变蓝.
(2)B中加入的物质是,其作用是干燥氨气.
(3)实验时C中观察到的现象是黑色固体逐渐变成红色.
(4)若要检验反应生成的水,可将试管D及烧杯部分改成两个相连的干燥管,第一个干燥管X内装有无水硫酸铜,现象是白色固体变蓝色;第二个干燥管Y内装有碱石灰,作用是防止E中的水蒸气进入干燥管X,影响水的检验.
分析 (1)氯化铵与氢氧化钙在加热条件下反应生成氨气、氯化钙、水;氨气溶于水与水反应生成一水合氨,一水合氨为弱碱,部分电离产生铵根离子与氢氧根离子,溶液呈碱性;
(2)氨气通入C中加热之前应进行干燥,依据氨气为碱性气体应选择碱性干燥剂解答;
(3)氨气与氧化铜在加热条件下发生氧化还原反应生成铜和氮气、水;
(4)无水硫酸铜与水反应生成蓝色的胆矾,常用无水硫酸铜检验水的存在;
解答 解:(1)氯化铵与氢氧化钙在加热条件下反应生成氨气、氯化钙、水,化学方程式:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,氨气溶于水与水反应生成一水合氨,一水合氨为弱碱,部分电离产生铵根离子与氢氧根离子,溶液呈碱性,能够使石蕊的红色石蕊试纸变蓝;
故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;用湿润的红色石蕊试纸检验,试纸变蓝;
(2)氨气通入C中加热之前应进行干燥,碱石灰属于碱性干燥剂,能够干燥氨气;
故答案为:碱石灰,干燥氨气;
(3)氨气与氧化铜在加热条件下发生氧化还原反应生成铜和氮气、水,所以看到黑色的固体逐渐变为红色;
故答案为:黑色固体逐渐变成红色;
(4)可用无水硫酸铜检验是否生成水,另外为防止E中的水蒸气干扰检验结果,可再连接盛有碱石灰的干燥管,
故答案为:无水硫酸铜,白色固体变蓝色;防止E中的水蒸气进入干燥管X,影响水的检验.
点评 本题为实验题,考查了氨气的制备和性质的检验,侧重考查氨气还原性检验,熟悉反应原理及氨气的性质是解题关键,题目难度中等.

练习册系列答案
相关题目
7.已知CH3COOH与NH3•H2O的电解质强弱程度相当.室温下,向稀醋酸溶液中加入一定量的某物质后由水电离产生c(H+)=1.0×10-7mol•L-1,则加入的物质可能是( )
| A. | NaCl | B. | NaHSO4 | C. | CH3COONa | D. | CH3COONH4 |
3.NaF、NaI、MgO晶体均为离子晶体,根据下列数据,这三种晶体的熔点高低顺序是( )
| 物质 | NaF | NaI | MgO |
| 离子所带电荷数 | 1 | 1 | 2 |
| 离子核间距离/10-10m | 2.31 | 3.18 | 2.10 |
| A. | NaF>NaI>MgO | B. | MgO>NaF>NaI | C. | MgO>NaI>NaF | D. | NaI>NaF>MgO |
7.在一定条件下,A2(g)+B2(g)?2AB(g) 达到平衡的标志是( )
| A. | 压强不再发生变化 | |
| B. | 平衡时A2、B2、AB的浓度之比是1:1:2 | |
| C. | 单位时间内生成nmol A2的同时生成nmol B2 | |
| D. | 单位时间内有n个A-A断裂的同时有2n 个A-B断裂 |
17.向0.4mol/L 500mL的石灰水中通入SO2气体,得12g白色沉淀,则SO2的体积可能为( )
| A. | 2.24L或4.48L | B. | 2.24L或6.72L | C. | 4.48L或8.96L | D. | 6.72L或8.96L |
4.下列实验中,不能观察到明显现象的是( )
| A. | 把氯气通入到氯化亚铁溶液中 | B. | 把绿豆大的钾投入无水乙醇中 | ||
| C. | 把碘化钾溶液滴入淀粉溶液中 | D. | 把乙烯通入溴水中 |
1.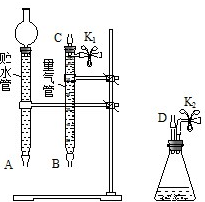 某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
(1)现有以下仪器和用品:橡胶管、秒表、温度计、a mol/L 稀硝酸、b mol/L 稀硝酸及图中仪器.
①写出本实验的化学方程式:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,并标出电子转方向和数目: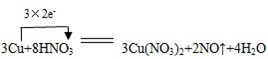 .
.
②设计实验方案:在相同稀硝酸浓度、不同温度(或相同温度、不同稀硝酸浓度下,测定相同时间内产生气体体积(或产生相同体积的气体所需的时间).
③在如图中将 A、B、C、D、几处用橡胶管以正确方式连接起来,以测定反应所产生气体的体积(三个容器中的液体和水都已出).
④测定前,为避免 NO 被氧化为 NO2,要用 CO2排出锥形瓶和橡胶管中的空气:在锥形瓶中加入铜片后松开 K2弹簧夹,从 K2处的橡胶管向装置中通入 CO2,此时 K1处应进行的操作是松开K1弹簧夹,接导管通入澄清石灰水至出现白色浑浊为止,则空气已排尽.
(2)注入稀硝酸后,在给定条件下设计实验探究浓度和温度对化学反应速率的影响:温度25℃、50℃;时间 t1、t2、t3;收集气体体积 V1、V2.请完成表:
 某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.(1)现有以下仪器和用品:橡胶管、秒表、温度计、a mol/L 稀硝酸、b mol/L 稀硝酸及图中仪器.
①写出本实验的化学方程式:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,并标出电子转方向和数目:
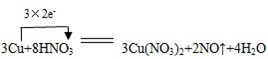 .
.②设计实验方案:在相同稀硝酸浓度、不同温度(或相同温度、不同稀硝酸浓度下,测定相同时间内产生气体体积(或产生相同体积的气体所需的时间).
③在如图中将 A、B、C、D、几处用橡胶管以正确方式连接起来,以测定反应所产生气体的体积(三个容器中的液体和水都已出).
④测定前,为避免 NO 被氧化为 NO2,要用 CO2排出锥形瓶和橡胶管中的空气:在锥形瓶中加入铜片后松开 K2弹簧夹,从 K2处的橡胶管向装置中通入 CO2,此时 K1处应进行的操作是松开K1弹簧夹,接导管通入澄清石灰水至出现白色浑浊为止,则空气已排尽.
(2)注入稀硝酸后,在给定条件下设计实验探究浓度和温度对化学反应速率的影响:温度25℃、50℃;时间 t1、t2、t3;收集气体体积 V1、V2.请完成表:
| 实验编号 | 稀硝酸的浓度 /(mol/L) | 稀硝酸的体积 /mL | 温度 /℃ | 时间 /min | 收集气体的体积/mL |
| ① | a | V | 25 | t1 | V1 |
| ② | V | ||||
| ③ | V |
2.根据转化关系判断下列说法正确的是( )


| A. | 反应①中(C6H10O5)n可表示淀粉或纤维素 | |
| B. | 反应②属于氧化反应 | |
| C. | 将在空气中灼烧后的铜丝趁热插入乙醇中可得到乙酸 | |
| D. | 反应③得到的乙酸乙酯中含有乙醇和乙酸,可用饱和氢氧化钠溶液除去 |