题目内容
7.在一定条件下,A2(g)+B2(g)?2AB(g) 达到平衡的标志是( )| A. | 压强不再发生变化 | |
| B. | 平衡时A2、B2、AB的浓度之比是1:1:2 | |
| C. | 单位时间内生成nmol A2的同时生成nmol B2 | |
| D. | 单位时间内有n个A-A断裂的同时有2n 个A-B断裂 |
分析 可逆反应A2(g)+B2(g)?2AB(g)为气体体积不变的反应,该反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行解答.
解答 解:A.该反应为气体体积不变的反应,压强始终不变,不能根据压强判断平衡状态,故A错误;
B.平衡时A2、B2、AB的浓度之比是1:1:2,无法判断各组分的浓度是否不再变化,则无法判断是否达到平衡状态,故B错误;
C.单位时间内生成nmol A2的同时生成nmol B2,表示的都是逆反应速率,无法判断正逆反应速率是否相等,故C错误;
D.单位时间内有n个A-A断裂的同时有2n 个A-B断裂,表明正逆反应速率相等,该反应已经达到平衡状态,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,注意反应前后气体体积不变的反应,不能用压强判断平衡状态,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案
相关题目
2.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 25℃时,0.1mol/L pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | NaHCO3溶液:c(OH-)=c(H+)+c(H2CO3-)-c(CO32-) | |
| C. | 25℃时,pH=9、浓度均为0.1 mol/L的NH3•H2O、NH4Cl混合溶液:c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol/L(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
18.把1L含乙烯和H2的混合气体通过Ni催化剂,使乙烯和H2发生加成反应,完全反应后,气体体积变为yL(气体体积均在同温、同压下测定).若乙烯在1L混合气体中的体积分数为a%,则a%和y的关系一定不正确的是( )
| A. | y=1×a% | B. | y=1-1×a% | C. | y=1×a%=0.5 | D. | y=1-1×a%<0.5 |
15.等物质的量的下列烃完全燃烧,消耗O2最多的是( )
| A. | 甲烷 | B. | 乙烯 | C. | 乙炔 | D. | 苯 |
2.下列有关共价化合物的说法中,一定正确的是( )
①具有较低的熔、沸点
②不是电解质
③固体时是分子晶体
④都由分子构成
⑤液态时不导电.
①具有较低的熔、沸点
②不是电解质
③固体时是分子晶体
④都由分子构成
⑤液态时不导电.
| A. | ①③④ | B. | ②④⑤ | C. | ①②③④⑤ | D. | 只有⑤ |
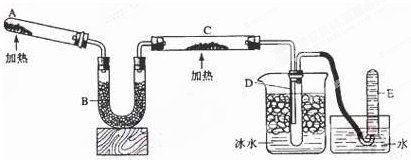
16.如图有关实验原理、装置、操作或结论的描述中,不正确的是(有关装置中的夹持仪器略去未画)( )
| A. |  实验室用大理石与盐酸制取CO2 | B. |  制取SO2、检验SO2的漂白性 | ||
| C. | 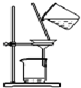 分离硫酸铜晶体 | D. | 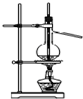 分离乙醇和水 |
17.现有铁和铜组成的合金共a mol,其中Cu的物质的量分数为x,研成粉末状后全部投入含bmol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO.试回答下列问题:
(1)随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有六种情况,请用粒子符号填写下列表1空白:
(2)若残留固体只有铜时,则溶液中可能存在的金属离子为(填粒子符号)Fe2+或Fe2+、Cu2+;
若合金全部溶解,则溶液中可能存在的金属离子为(填粒子符号)Fe2+、Cu2+或Fe3+、Fe2+、Cu2+或Fe3+、Cu2+;
(3)当溶液中金属离子只有Fe2+、Cu2+时,b的取值范围(用a,x表示)$\frac{8}{3}$a≥b>$\frac{8}{3}$a(1-x);
(4)当x=0.5,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生672mLNO.
则a=0.04,b=0.12.
(1)随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有六种情况,请用粒子符号填写下列表1空白:
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 溶液中的金属离子 | Fe2+ | Fe2+、Cu2+ | Cu2+、Fe3+ | |||
| 残留固体成分 | Fe、Cu | Cu |
若合金全部溶解,则溶液中可能存在的金属离子为(填粒子符号)Fe2+、Cu2+或Fe3+、Fe2+、Cu2+或Fe3+、Cu2+;
(3)当溶液中金属离子只有Fe2+、Cu2+时,b的取值范围(用a,x表示)$\frac{8}{3}$a≥b>$\frac{8}{3}$a(1-x);
(4)当x=0.5,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生672mLNO.
则a=0.04,b=0.12.