题目内容
7.化学能可与热能、电能等相互转化.下列表述不正确的是( )
| A. | 化学反应中能量变化的主要原因是化学键的断裂与形成 | |
| B. | 中和反应中,反应物的总能量比生成物的总能量高 | |
| C. | 图I所示的装置能将化学能转变为电能 | |
| D. | 图II所示的反应为放热反应 |
分析 A.化学反应总是伴随着能量变化,断键需要吸收能量,成键放出能量;
B.反应物总能量大于生成物总能量,则该反应是放热反应;
C.原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应;
D.反应物总能量小于生成物总能量时该反应为吸热反应.
解答 解:A.化学反应总是伴随着能量变化,断键需要吸收能量,成键放出能量,所以化学反应中能量变化的主要原因是化学键的断裂与生成,故A正确;
B.中和反应是放热反应,所以反应物总能量大于生成物总能量,故B正确;
C.该装置不能构成闭合回路,所以不能形成原电池,即不能将化学能转变为电能,故C错误;
D.根据图象Ⅱ知,反应物总能量大于生成物总能量,则该反应是放热反应,故D正确;
故选C.
点评 本题考查了反应热、原电池原理等知识点,明确反应物和生成物能量相对大小与反应热的关系、原电池构成条件即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列化学用语正确的是( )
| A. | 乙烯的结构简式可表示为CH2CH2 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 甲烷的结构式:CH4 | D. | 甲苯的键线式可表示为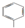 |
15.某有机物的结构简式如图,有关说法正确的是( )


| A. | 该物质共有两种含氧官能团 | |
| B. | 该物质属于芳香烃 | |
| C. | 1 mol该有机物能与3mol的NaOH反应 | |
| D. | 1 mol该有机物在一定条件下可以消耗6molH2 |
2.下列有关元素周期表的说法正确的是( )
| A. | 第I A族元素都是碱金属元素 | |
| B. | 元素周期表中有18个纵行,所以有18个族 | |
| C. | 可以从过渡金属中寻找新型催化剂 | |
| D. | 主族元素的金属元素原子最外层电子数一定小于或等于4 |
12. 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法不正确的是( )
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法不正确的是( )
 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法不正确的是( )
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法不正确的是( )| A. | H2O的分解反应是吸热反应 | |
| B. | 过程①是太阳能转换成化学能 | |
| C. | 过程②是化学能转换为电能 | |
| D. | 氢气不易贮存和运输,无开发利用价值 |
16. 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列说法是正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列说法是正确的是( )
 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列说法是正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列说法是正确的是( )| A. | 洗气瓶中产生的沉淀是碳酸钡 | |
| B. | 从Z导管出来的气体中无二氧化碳 | |
| C. | 洗气瓶中产生的沉淀是碳酸钡和硫酸钡的混合物 | |
| D. | 在导管中有红棕色气体出现 |
17.已知同温同浓度时,①H2CO3比H2S的电离(一级电离)常数大,②H2S比HCO3-的电离常数大(即H2S的K1比H2CO3的K2大),根据酸与盐的反应规律,下列反应中不正确的是( )
| A. | Na2CO3+H2S=NaHCO3+NaHS | B. | Na2S+H2O+CO2=NaHS+NaHCO3 | ||
| C. | 2NaHCO3+H2S=Na2S+2H2O+2CO2 | D. | NaHS+H20+CO2=NaHCO3+H2S |
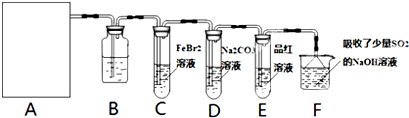
 某温度时,在2L容器中X、Y、Z三种物质随时间的变化曲线如图所示,由图中的数据分析,反应开始至2min时:
某温度时,在2L容器中X、Y、Z三种物质随时间的变化曲线如图所示,由图中的数据分析,反应开始至2min时: