题目内容
16. 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列说法是正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列说法是正确的是( )| A. | 洗气瓶中产生的沉淀是碳酸钡 | |
| B. | 从Z导管出来的气体中无二氧化碳 | |
| C. | 洗气瓶中产生的沉淀是碳酸钡和硫酸钡的混合物 | |
| D. | 在导管中有红棕色气体出现 |
分析 碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体,铜与浓硝酸反应产生的Y气体是NO2,同时通入时因NO2与水和SO2共同作用要产生SO42-和NO,NO在空气中又会生成NO2,以此解答该题.
解答 解:碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体,铜与浓硝酸反应产生的Y气体是NO2,SO2+H2O+NO2=H2SO4+NO,故洗气瓶中产生的是硫酸钡沉淀,Z处逸出的气体中有CO2和NO,NO遇到空气中的氧气生成了红棕色的NO2.
A.由上述分析可知,沉淀为硫酸钡,故A错误;
B.由上述分析可知,Z处逸出的气体中有CO2和NO,故B错误;
C.由上述分析可知,沉淀为硫酸钡,故C错误;
D.NO遇到空气中的氧气生成了红棕色的NO2,则在导管中有红棕色气体出现,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握发生的反应和现象、含氮物质的性质为解答的关键,侧重分析与实验能力的考查,注意相关反应原理及实验评价性分析,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
6.在一定温度下的恒容的密闭容器中,当下列物理量不再发生变化时,可逆反应H2(g)+I2(g)═2HI(g)达到平衡状态的是( )
| A. | 混合气体的压强恒定不变 | |
| B. | 混合气体的密度不再改变 | |
| C. | H2、I2、HI的浓度相等 | |
| D. | I2在混合气体中的体积分数不再改变 |
7.化学能可与热能、电能等相互转化.下列表述不正确的是( )


| A. | 化学反应中能量变化的主要原因是化学键的断裂与形成 | |
| B. | 中和反应中,反应物的总能量比生成物的总能量高 | |
| C. | 图I所示的装置能将化学能转变为电能 | |
| D. | 图II所示的反应为放热反应 |
5.下列关于卤素的说法正确的是( )
| A. | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到上层液体呈紫色 | |
| B. | 液溴有强挥发性,保存时应加少量水液封 | |
| C. | Cl2可以从NaBr水溶液中置换出溴单质,可类推F2可以从NaCl水溶液中置换出氯单质 | |
| D. | HX的还原性顺序为:HF>HCl>HBr>HI |
10.生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(l)请完成以下实验设计表(表中不要留空格)
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示.
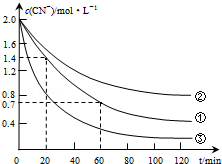
(2)实验①中20~60min时间段反应速率:υ(CN-)=0.0175mol•L-1•min-1.
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化)(填一点即可).在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN-浓度可用离子色谱仪测定)
【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(l)请完成以下实验设计表(表中不要留空格)
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |

(2)实验①中20~60min时间段反应速率:υ(CN-)=0.0175mol•L-1•min-1.
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化)(填一点即可).在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN-浓度可用离子色谱仪测定)
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
 ,用电子式表示X与R化合物的形成过程
,用电子式表示X与R化合物的形成过程
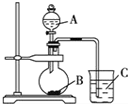 某研究性学习小组设计了一组实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他们设计了如图装置以验证 氮、碳、硅元素的非金属性强弱.他们设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成.
某研究性学习小组设计了一组实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他们设计了如图装置以验证 氮、碳、硅元素的非金属性强弱.他们设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成. .
.