题目内容
2.下列有关元素周期表的说法正确的是( )| A. | 第I A族元素都是碱金属元素 | |
| B. | 元素周期表中有18个纵行,所以有18个族 | |
| C. | 可以从过渡金属中寻找新型催化剂 | |
| D. | 主族元素的金属元素原子最外层电子数一定小于或等于4 |
分析 A、ⅠA族的氢元素是非金属;
B、元素周期表中有18个纵行,所以有16个族;
C、过渡元素中一些金属元素的化合物具有良好的催化作用;
D、金属元素的原子最外层电子数一般小于4.
解答 解:A、ⅠA族的氢元素是非金属,故A错误;
B、元素周期表中有18个纵行,所以有16个族,第ⅤⅢ族3列,故B错误;
C、过渡元素中一些元素的化合物具有良好的催化作用,则在过渡元素中可以找到新型催化剂,故C正确;
D、金属元素的原子最外层电子数一般小于4,而在ⅣA、ⅤA、ⅥA族的金属原子最外层电子数≥4,故D错误;
故选C.
点评 本题考查元素周期表的结构及应用,为高频考点,把握周期表的结构及原子结构与元素位置、性质的关系为解答的关键,注重基础知识的考查,选项D为易错点,题目难度不大.

练习册系列答案
 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
10.核内中子数为N的R2+离子,质量数为A,则ng它的氧化物中所含质子的物质的是( )
| A. | $\frac{n}{16+A}$(A-N+8)mol | B. | $\frac{n}{16+A}$(A-N+10)mol | C. | (A-N+2)mol | D. | $\frac{n}{A}$(A-N+6)mol |
7.化学能可与热能、电能等相互转化.下列表述不正确的是( )


| A. | 化学反应中能量变化的主要原因是化学键的断裂与形成 | |
| B. | 中和反应中,反应物的总能量比生成物的总能量高 | |
| C. | 图I所示的装置能将化学能转变为电能 | |
| D. | 图II所示的反应为放热反应 |
14.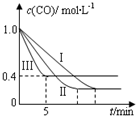 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+163.9kJ•mol-1.
(2)为了探究反应条件对反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
的影响,某活动小组设计了三个实验,实验曲线如图所示
①请依据实验曲线图补充完整表格中的实验条件:X=530℃,Y=5MPa.
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=0.12mol•L-1•min-1.
③实验Ⅱ达平衡时CO的转化率大于 实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往10L容器中投入2.0mol CO(g)、2.0mol H2O(g)、1.0mol CO2(g)、1.0mol H2(g),此时化学反应将正向(填“正向”、“逆向”或“不”) 移动.
 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+163.9kJ•mol-1.
(2)为了探究反应条件对反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
的影响,某活动小组设计了三个实验,实验曲线如图所示
| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅱ | X | Y | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol•L-1 | 3.0mol•L-1 |
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=0.12mol•L-1•min-1.
③实验Ⅱ达平衡时CO的转化率大于 实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往10L容器中投入2.0mol CO(g)、2.0mol H2O(g)、1.0mol CO2(g)、1.0mol H2(g),此时化学反应将正向(填“正向”、“逆向”或“不”) 移动.
12.下列常温下的下列物质属于所气态有机物的是 ( )
| A. | CH3Cl | B. | CH2Cl2 | C. | CCl4 | D. | 苯 |
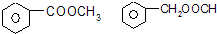 .
. 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义. )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: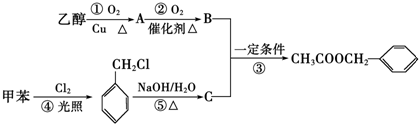
 .
. ;
; .
. ,用电子式表示X与R化合物的形成过程
,用电子式表示X与R化合物的形成过程