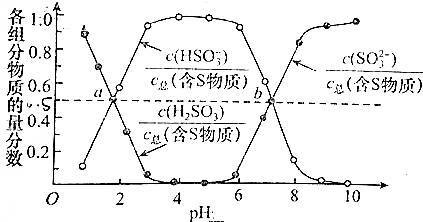
题目内容
19.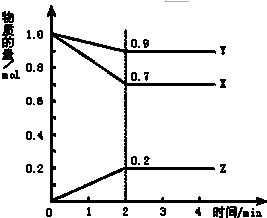 某温度时,在2L容器中X、Y、Z三种物质随时间的变化曲线如图所示,由图中的数据分析,反应开始至2min时:
某温度时,在2L容器中X、Y、Z三种物质随时间的变化曲线如图所示,由图中的数据分析,反应开始至2min时:(1)用Z表示的平均反应速率为0.05mol/(L•min),用Y表示的平均反应速率为0.025mol/L•min,用X表示的平均反应速率为0.075mol/L•min,
(2)该反应的化学方程式为3X+Y?2Z.
分析 (1)根据v=$\frac{△c}{△t}$进行计算XYZ的反应速率,;
(2)根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式.
解答 解:(1)反应开始至2min末,Z的反应速率为:v=$\frac{△c}{△t}$=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),v(X)=$\frac{\frac{1.0mol-0.7mol}{2L}}{2min}$=0.075mol/L•min,v(Y)=$\frac{\frac{1.0mol-0.9mol}{2L}}{2min}$=0.025mol/L•min,
故答案为:0.05mol/(L•min);0.025mol/L•min;0.075mol/L•min;
(2)由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,
当反应进行到2min时,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,
则△n(X):△n(Y):△n(Z)=3:1:2,参加反应的物质的物质的量之比等于化学计量数之比,
则反应的方程式为:3X+Y?2Z,
故答案为:3X+Y?2Z.
点评 本题考查化学反应速率图象题目,题目难度不大.把握化学反应速率的定义和化学反应速率之比等化学计量数之比为解答的关键.

练习册系列答案
相关题目
10.核内中子数为N的R2+离子,质量数为A,则ng它的氧化物中所含质子的物质的是( )
| A. | $\frac{n}{16+A}$(A-N+8)mol | B. | $\frac{n}{16+A}$(A-N+10)mol | C. | (A-N+2)mol | D. | $\frac{n}{A}$(A-N+6)mol |
7.化学能可与热能、电能等相互转化.下列表述不正确的是( )


| A. | 化学反应中能量变化的主要原因是化学键的断裂与形成 | |
| B. | 中和反应中,反应物的总能量比生成物的总能量高 | |
| C. | 图I所示的装置能将化学能转变为电能 | |
| D. | 图II所示的反应为放热反应 |
14.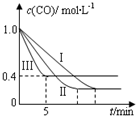 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+163.9kJ•mol-1.
(2)为了探究反应条件对反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
的影响,某活动小组设计了三个实验,实验曲线如图所示
①请依据实验曲线图补充完整表格中的实验条件:X=530℃,Y=5MPa.
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=0.12mol•L-1•min-1.
③实验Ⅱ达平衡时CO的转化率大于 实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往10L容器中投入2.0mol CO(g)、2.0mol H2O(g)、1.0mol CO2(g)、1.0mol H2(g),此时化学反应将正向(填“正向”、“逆向”或“不”) 移动.
 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+163.9kJ•mol-1.
(2)为了探究反应条件对反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
的影响,某活动小组设计了三个实验,实验曲线如图所示
| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅱ | X | Y | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol•L-1 | 3.0mol•L-1 |
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=0.12mol•L-1•min-1.
③实验Ⅱ达平衡时CO的转化率大于 实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往10L容器中投入2.0mol CO(g)、2.0mol H2O(g)、1.0mol CO2(g)、1.0mol H2(g),此时化学反应将正向(填“正向”、“逆向”或“不”) 移动.




 ,用电子式表示X与R化合物的形成过程
,用电子式表示X与R化合物的形成过程
 .
.