题目内容
17.氯气是一种重要的化工原料.某化学学习小组在实验室中利用如图所示装置制取氯气并探究其性质.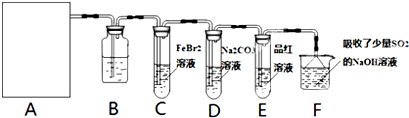
(1)若A是用二氧化锰和浓盐酸反应制取氯气的发生装置,除圆底烧瓶和导管外还用到的玻璃仪器有酒精灯、分液漏斗;
(2)装置B中盛有的试剂是饱和食盐水,作用是吸收氯气中的氯化氢.
(3)若E中品红溶液褪色,则C装置中发生反应的离子方程式是2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-.为了证明确实发生了此反应,可在实验后,取少量C中溶液,滴加KSCN溶液,溶液变为血红色;另取少量C中溶液,加入CCl4萃取,CCl4层变为橙色(填实验步骤和现象).
(4)吸收尾气一段时间后,F中溶液仍呈强碱性,且一定存在Cl-、OH-、CO32-和SO42-.对于可能存在的其他阴离子,该小组提出了3种假设.
假设1:只存在SO32-; 假设2:只存在ClO-;
假设3:既不存在SO32-,也不存在ClO-;
①同时存在SO32-和ClO-是不可能的,理由是SO32-与ClO-能发生氧化还原反应,故不能共存.
②为判断假设是否正确,该小组设计如下实验方案,请完善实验步骤并填写预期现象.限选试剂如下所示:
a.3mol/L 硫酸 b.0.01mol/L KMnO4溶液 c.1mol/L BaCl2溶液
d.淀粉一KI溶液 e.酚酞试液
步骤一;取少量F中溶液,将其分别装于A、B两试管中.
步骤二:向A试管中滴加少量ab(填序号).若溶液褪色(填现象),则假设1成立.
步骤三:向B试管中滴加少量ad(填序号);若溶液变蓝色(填现象),则假设2成立,请写出反应的离子方程式:ClO-+2I-+2H+=I2+Cl-+H2O.
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,反应物状态为固体与液体,据此判断需要仪器;
(2)浓盐酸具有挥发性,加热能够促进浓盐酸的挥发,所以制取的氯气中含有氯化氢和水蒸气,依据二者性质选择除杂试剂;
(3)氯气具有很强的氧化性,能够和具有较强还原性的Fe2+发生反应;FeBr2与Cl2发生氧化还原反应,溴化亚铁中的二价铁先被氧化;
(4)①次氯酸具有强的氧化性,亚硫酸根离子具有强的还原性,二者发生氧化还原反应;
②酸性环境下,高锰酸钾具有强的氧化性,能够氧化亚硫酸根离子;
③次氯酸根离子在酸性环境下具有强的氧化性,能够氧化碘离子生成单质碘,碘遇到淀粉变蓝.
解答 解:(1)二氧化锰和浓盐酸反应制取氯气的方程式为:MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O,从方程式可知该反应需加热,需酒精灯,反应物浓盐酸的滴加以及防氯气的逸出需分液漏斗;
故答案为:分液漏斗、酒精灯;
(2)浓盐酸具有挥发性,加热能够促进浓盐酸的挥发,要制取纯净干燥的氯气应依次除去氯化氢和水蒸气,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以选择饱和食盐水除去氯气;
故答案为:饱和食盐水;吸收氯气中的氯化氢;
(3)若E中品红溶液褪色,说明经过E中有氯气,经过E中有氯气说明C装置中,溴化亚铁中的二价铁和溴离子均被氧化;因FeBr2与Cl2发生氧化还原反应,溴化亚铁中的二价铁先被氧化,所以只须证明有三价铁存在即可,KSCN溶液可与三价铁形成血红色的硫氰化铁可证明有三价铁存在,另取少量C中溶液,加入CCl4萃取,CCl4层变为橙色,证明有溴单质生成;
故答案为:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2;滴加KSCN溶液,溶液变为血红色;另取少量C中溶液,加入CCl4萃取,CCl4层变为橙色;
(4)①次氯酸具有强的氧化性,亚硫酸根离子具有强的还原性,二者发生氧化还原反应,所以二者不能共存;
故答案为:SO32-与ClO-能发生氧化还原反应,故不能共存;
②酸性环境下,高锰酸钾具有强的氧化性,能够氧化亚硫酸根离子,若看到溶液褪色,即可证明亚硫酸酸根离子的存在;
故答案为:ab;褪色;
③次氯酸根离子在酸性环境下具有强的氧化性,能够氧化碘离子生成单质碘离子方程式:ClO-+2I-+2H+=I2+Cl-+H2O,碘遇到淀粉变蓝;
故答案为:ad;变蓝色; ClO-+2I-+2H+=I2+Cl-+H2O.
点评 本题为综合题,设计氯气的制备、性质的检验,解题关键在于熟悉氯气制备原理、氯气性质,题目难度中等,注意实验设计的严密性.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案| A. | 2-甲基-4-乙基戊烷 | B. | 2-甲基-3-丁炔 | ||
| C. | 2,3-二乙基-1-戊烯 | D. | 三溴苯酚 |
| A. | CH3Cl | B. | CH2Cl | C. | CHCl3 | D. | HCl |
| A. | 混合气体的压强恒定不变 | |
| B. | 混合气体的密度不再改变 | |
| C. | H2、I2、HI的浓度相等 | |
| D. | I2在混合气体中的体积分数不再改变 |

| A. | 化学反应中能量变化的主要原因是化学键的断裂与形成 | |
| B. | 中和反应中,反应物的总能量比生成物的总能量高 | |
| C. | 图I所示的装置能将化学能转变为电能 | |
| D. | 图II所示的反应为放热反应 |
 配合物种类繁多,应用广泛.按要求完成下列各题:
配合物种类繁多,应用广泛.按要求完成下列各题: .
.


