题目内容
16. 25℃时部分弱电解质的电离平衡常数数据如表所示:
25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:
a.CH3COONa B.Na2CO3 c.NaClO D.NaHCO3
pH由小到大排列顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是B、D.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D. $\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c•({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
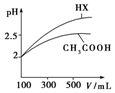
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是加水稀释相同倍数,一元酸的pH变化越大,酸性越强,电离平衡常数越大.
(4)84消毒液(主要成分NaClO)在空气中变质的离子方程式为CO2+ClO-+H2O═HClO+HCO3-2HClO═2H++2Cl-+O2↑.
分析 (1)弱酸的电离平衡常数越大,其酸性越强,其酸根的水解程度越弱;
(2)0.1mol/L的CH3COOH溶液加水稀释过程中,氢离子与醋酸根离子物质的量增大,醋酸分子物质的量减小,浓度减小,酸性减弱,水的离子积常数不变,醋酸的电离平衡常数不变;
(3)据图分析,加水稀释的过程中,HX的pH变化比较快,说明HX的酸性比醋酸强;
(4)图表中数据分析可知,酸性强弱:CH3COOH>H2CO3>HClO>>HCO3-,84消毒液(主要成分NaClO)在空气中变质是次氯酸钠吸收空气中二氧化碳反应生成碳酸氢钠和次氯酸,次氯酸见光分解生成盐酸和氧气;
解答 解:(1)据电离平衡常数可知,酸性由强到弱的顺序为:CH3COOH>H2CO3>HClO>HCO3-,弱酸的酸性越弱其酸根离子的水解程度越大,溶液碱性越强,所以pH由小到大排列顺序是a<d<c<b,故答案为:a<d<c<b;
(2)0.1mol/L的CH3COOH溶液加水稀释过程中,氢离子与醋酸根离子物质的量增大,浓度减小,酸性减弱,
A、氢离子浓度减小,故A错误;
B、加水稀释过程中,氢离子物质的量增大,醋酸分子物质的量减小,所以$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大,故B正确;
C、水的离子积常数不变,故C错误;
D、醋酸溶液加水稀释时酸性减弱,氢离子浓度减小氢氧根离子浓度增大,所以$\frac{c(O{H}^{-})}{c({H}^{+})}$增大,故D正确;
E、醋酸的电离平衡常数不变,故E错误;
故答案为:BD;
(3)据图分析,加水稀释的过程中,HX的pH变化比较快,说明HX的酸性比醋酸强,HX的电离平衡常数比醋酸大,
故答案为:大于;加水稀释相同倍数,一元酸的pH变化越大,酸性越强,电离平衡常数越大.
(4)酸性强弱:CH3COOH>H2CO3>HClO>>HCO3-,84消毒液(主要成分NaClO)在空气中变质是次氯酸钠吸收空气中二氧化碳反应生成碳酸氢钠和次氯酸,次氯酸见光分解生成盐酸和氧气,反应的离子方程式为:CO2+ClO-+H2O═HClO+HCO3- 2HClO═2H++2Cl-+O2↑,
故答案为:CO2+ClO-+H2O═HClO+HCO3- 2HClO═2H++2Cl-+O2↑.
点评 本题考查弱电解质的电离,根据平衡常数确定酸性强弱,从而确定水解程度,注意加水稀释时从各微粒的物质的量变化分析,题目难度中等.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
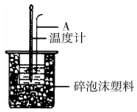 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)如图所示,仪器A的名称是环形玻璃搅拌棒;
(2)设溶液的密度均为1g•cm-3,中和后溶液的比热容c=4.18J•(g•℃)-1,请根据实验数据写出该中和热的热化学方程式$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-56.0kJ/mol
 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | ||
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)已知:CH3COOH(aq)与NaOH(aq)反应的△H=-12.1kJ•mol-1;HCl(aq)与NaOH(aq)反应的△H=-55.6kJ•mol-1.则CH3COOH在水溶液中电离的△H等于C
A.-67.7kJ•mol-1 B.-43.5kJ•mol-1C.+43.5kJ•mol-1 D.+67.7kJ•mol-1.
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |