题目内容
11.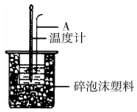 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
(1)如图所示,仪器A的名称是环形玻璃搅拌棒;
(2)设溶液的密度均为1g•cm-3,中和后溶液的比热容c=4.18J•(g•℃)-1,请根据实验数据写出该中和热的热化学方程式$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-56.0kJ/mol
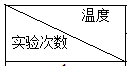 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | ||
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)已知:CH3COOH(aq)与NaOH(aq)反应的△H=-12.1kJ•mol-1;HCl(aq)与NaOH(aq)反应的△H=-55.6kJ•mol-1.则CH3COOH在水溶液中电离的△H等于C
A.-67.7kJ•mol-1 B.-43.5kJ•mol-1C.+43.5kJ•mol-1 D.+67.7kJ•mol-1.
分析 (1)仪器A的名称环形玻璃搅拌棒;
(2)先判断温度差的有效性,然后求出温度差平均值,先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;根据热化学方程式的书写方法来书写;
(3)a.实验装置保温、隔热效果差,热量散失较大;
b.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大;
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,硫酸的起始温度偏高;
(4)利用盖斯定律进行计算,分别写出两个反应的热化学方程式,将两个热化学方程式相加(减)得到CH3COOH在水溶液中电离的电离方程式,同时反应热也随之相加(减),可得CH3COOH在水溶液中电离的反应热;
解答 解:(1)如图所示,仪器A的名称是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
(2)第1次实验H2SO4和NaOH溶液起始平均温度为25.1℃,反应后温度为28.5℃,反应前后温度差为3.4℃;
第2次实验H2SO4和NaOH溶液起始平均温度为25.0℃,反应后温度为28.3℃,反应前后温度差为3.3℃;
第3次实验H2SO4和NaOH溶液起始平均温度为26.0℃,反应后温度为31.8℃,反应前后温度差为5.8℃;
第3次实验误差较大,舍去,其他三次实验的平均值为$\frac{3.4+3.3}{2}$℃=3.35℃,
50mL 0.25mol/L H2SO4溶液与50mL 0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为100ml×1g/ml=100g,温度变化的值为三次实验的平均值3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.35℃=1400.3J,即1.4003kJ,
所以实验测得的中和热△H=-$\frac{1.4003kJ}{0.025mol}$=-56.0kJ/mol,该反应的热化学方程式:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-56.0kJ/mol;
故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-56.0kJ/mol;
(3)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故b正确;
c.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故c正确.
故答案为:abc;
(4)CH3COOH(aq)+OH-(aq)═CH3COO-(aq)+H2O(l)△H=-12.1kJ•mol-1 ①
H+(aq)+OH-(aq)═H2O(l)△H=-55.6kJ•mol-②
用①-②可得CH3COOH电离的热化学方程式为:CH3COOH(aq) H+(aq)+CH3COO-(aq)△H=-12.1kJ•mol-1-(-55.6kJ•mol-1)=+43.5kJ•mol-1,
H+(aq)+CH3COO-(aq)△H=-12.1kJ•mol-1-(-55.6kJ•mol-1)=+43.5kJ•mol-1,
故选C.
点评 本题考查热化学方程式以及反应热的测定与计算,题目难度大,注意理解测定原理、把握热化学方程式的书写方法等问题.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案| A. | Na2SO4溶液和MgCl2溶液 | B. | Na2CO3溶液和稀硫酸 | ||
| C. | NaOH溶液和Fe(SO4)3溶液 | D. | Ca(OH)2溶液和盐酸 |
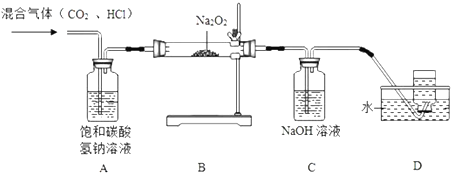
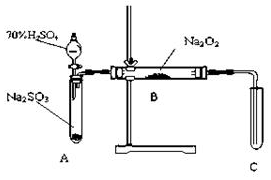 化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:
化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:(1)请你完成装置改进的措施和理由:
①措施:在A、B之间加一个干燥管,作用产生二氧化硫没有干燥,水蒸气会与Na2O2反应.
②措施:为确保C中的实验现象发生,在B、C之间加一个装有NaOH溶液的洗气瓶,作用除去SO2气体防止污染空气.
(2)某同学推断该白色固体为Na2SO3,则其化学反应方程式是2Na2O2+2CO2=2Na2CO3+O2.
(3)任何的推论都要经过检验,请完成对白色固体成分的探究:
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、带单孔胶塞的导管、棉花、试管夹;3mol•L-1HCl、6mol•L-1HNO3、NaOH稀溶液、蒸馏水、1mol•L-1 BaCl2溶液、澄清石灰水、品红溶液.
①提出合理假设:
假设1:白色固体为Na2SO3; 假设2:白色固体为Na2SO4 ;
假设3:白色固体为Na2SO3与Na2SO4的混合物.
②设计实验方案证明以上三种假设,并按表格式写出实验操作步骤、预期现象与结论.
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量白色固体于试管,加入过量3mol•L-1的稀盐酸,塞上单孔胶塞,将生成的气体通入品红溶液. | 若有能使品红溶液褪色的无色气体生成,说明白色固体含有Na2SO3,则假设1或3成立,若无该现象,则假设2成立. |
| 步骤2:在步骤1反应后的溶液加入1mol•L-1BaCl2溶液. | 若有白色沉淀生成,则说明白色固体含Na2SO4. 结合步骤1的结论,则假设3成立,若无该现象,则假设1成立. |
(2)填表:(类别选填“单质”、“氧化物”、“酸”、“碱”、“盐:
| 名称 | 氢氧化镁 | 银 | |
| 化学式 | HNO3 | Mg(OH)2 | |
| 类别 | 酸 | 单质 |
 25℃时部分弱电解质的电离平衡常数数据如表所示:
25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:
a.CH3COONa B.Na2CO3 c.NaClO D.NaHCO3
pH由小到大排列顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是B、D.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D. $\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c•({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
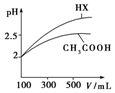
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是加水稀释相同倍数,一元酸的pH变化越大,酸性越强,电离平衡常数越大.
(4)84消毒液(主要成分NaClO)在空气中变质的离子方程式为CO2+ClO-+H2O═HClO+HCO3-2HClO═2H++2Cl-+O2↑.
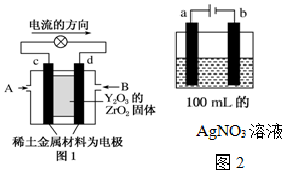 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-═2O2-).
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-═2O2-).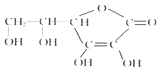 维生素C的结构简式如图所示:
维生素C的结构简式如图所示: 在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为0.1mol/L.
在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为0.1mol/L.