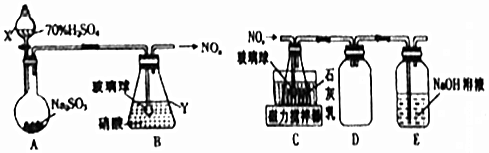
题目内容
1.在标准状况下,CO和CO2的混合气体质量为36g,体积为20.16L,则CO所占的体积是5.04 L,CO2的质量是29.7g.分析 根据n=$\frac{V}{{V}_{m}}$计算混合气体的物质的量,令混合气体中CO和CO2的物质的量分别为xmol、ymol,根据二者质量之和与物质的量之和列放出计算x、y的值,再根据V=nVm计算CO的体积,根据m=nM计算CO2的质量.
解答 解:标准状况下,混合气体的物质的量为$\frac{20.16L}{22.4L/mol}$=0.9mol,
令混合气体中CO和CO2的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.9}\\{28x+44y=36}\end{array}\right.$
解得:x=0.225,y=0.675;
则CO所占的体积为:22.4L/mol×0.225mol=5.04L;
CO2的质量为:0.675mol×44g/mol=29.7g;
故答案为:5.04;29.7.
点评 本题考查物质的量的有关计算、混合物的有关计算等,比较基础,注意对基础知识的理解掌握,注意对公式的理解与运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.表列出了A-R 9种元素在周期表中的位置:
(1)这9种元素中化学性质最不活泼的是Ar;金属性最强的是K (用元素符号表示).
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O;
(3)A、B、C、G四种元素的简单离子半径由大到小的顺序排列为Cl->K+>Na+>Mg2+.(用离子符号回答)
(4)F元素氢化物的化学式是H2O.该氢化物在常温下跟B单质发生反应的离子方程式2K+2H2O═2K++2OH-+H2↑;
(5)H元素的最高价含氧酸与G的最高价含氧酸比较酸性更强的是HClO4 (填化学式)
(6)G元素与H元素两者核电荷数之差是18:写出C元素原子结构示意图 .
.
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O;
(3)A、B、C、G四种元素的简单离子半径由大到小的顺序排列为Cl->K+>Na+>Mg2+.(用离子符号回答)
(4)F元素氢化物的化学式是H2O.该氢化物在常温下跟B单质发生反应的离子方程式2K+2H2O═2K++2OH-+H2↑;
(5)H元素的最高价含氧酸与G的最高价含氧酸比较酸性更强的是HClO4 (填化学式)
(6)G元素与H元素两者核电荷数之差是18:写出C元素原子结构示意图
 .
.
12.下列仪器:①漏斗、②容量瓶、③蒸馏烧瓶、④天平、⑤分液漏斗、⑥滴定管、⑦燃烧匙,常用于分离物质的仪器是( )
| A. | ①②⑥ | B. | ①③⑤ | C. | ②④⑥ | D. | ③④⑦ |
16. 25℃时部分弱电解质的电离平衡常数数据如表所示:
25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:
a.CH3COONa B.Na2CO3 c.NaClO D.NaHCO3
pH由小到大排列顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是B、D.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D. $\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c•({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
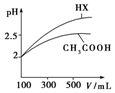
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是加水稀释相同倍数,一元酸的pH变化越大,酸性越强,电离平衡常数越大.
(4)84消毒液(主要成分NaClO)在空气中变质的离子方程式为CO2+ClO-+H2O═HClO+HCO3-2HClO═2H++2Cl-+O2↑.
 25℃时部分弱电解质的电离平衡常数数据如表所示:
25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:
a.CH3COONa B.Na2CO3 c.NaClO D.NaHCO3
pH由小到大排列顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是B、D.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D. $\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c•({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是加水稀释相同倍数,一元酸的pH变化越大,酸性越强,电离平衡常数越大.
(4)84消毒液(主要成分NaClO)在空气中变质的离子方程式为CO2+ClO-+H2O═HClO+HCO3-2HClO═2H++2Cl-+O2↑.
6.含有6.02×1023个O原子的H3PO4的物质的量是( )
| A. | 1 mol | B. | 0.5 mot | C. | 0.25 mol | D. | 0.125 mol |
13.下列实验操作正确的是( )
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶内的液面以下 | |
| C. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用滴管滴加液体时滴管应垂直悬垂在容器上方且不能触及容器内壁 |
10.与OHCCH2CH2CHO互为同系物且相对分子质量比其大28的同分异构体有( )
| A. | 5种 | B. | 7种 | C. | 9种 | D. | 11种 |